Solved NCERT Questions For Class 11 Chemistry Chapter 4 In Hindi - Free PDF
Download the Class 11 Chemistry NCERT Solutions in Hindi medium and English medium as well offered by the leading e-learning platform Vedantu. If you are a student of Class 11, you have reached the right platform. The NCERT Solutions for Class 11 Chemistry in Hindi provided by us are designed in a simple, straightforward language, which are easy to memorise. You will also be able to download the PDF file for NCERT Solutions for Class 11 Chemistry in Hindi from our website at absolutely free of cost.
 Table of Content
Table of ContentNCERT, which stands for The National Council of Educational Research and Training, is responsible for designing and publishing textbooks for all the classes and subjects. NCERT textbooks covered all the topics and are applicable to the Central Board of Secondary Education (CBSE) and various state boards.
We, at Vedantu, offer free NCERT Solutions in English medium and Hindi medium for all the classes as well. Created by subject matter experts, these NCERT Solutions in Hindi are very helpful to the students of all classes.
Note: ➤Calculate your potential NEET rank based on marks with our NEET Rank Predictor by Marks!
NCERT Solutions for Class 11 Chemistry Chapter 4 Chemical Bonding and Molecular Structure in Hindi
1. रासायनिक आबंध के बनने की व्याख्या कीजिए।
उत्तर:
\[\begin{gathered} 1s \\ 2s \\ 2p \\ 22 \\ {H_2}\left( g \right){\text{ }}433{\text{ }}kJ{\text{ }}mo{l^{ - 1}} \to {\text{ }}H\left( g \right) + H\left( g \right) \\ {\mathbf{\sigma }} \\ {\mathbf{s}}{{\mathbf{p}}^{\mathbf{2}}} \\ {\mathbf{s}}{{\mathbf{p}}^{\mathbf{3}}} \\ s{p^3}d \\ 90^\circ \\ Al:{\text{ }}1{s^2}2{s^2}2{p^6}3{s^1}3{p^1}x{\text{ }}3{p^1}--){\text{ }}AlC{l^--}4 \\ \end{gathered} \]
द्रव्य’ एक या विभिन्न प्रकार के तत्वों से मिलकर बना होता है। सामान्य स्थितियों में उत्कृष्ट गैसों के अतिरिक्त कोई अन्य तत्व एक स्वतन्त्र परमाणु के रूप में विद्यमान नहीं होता है। परमाणुओं के समूह विशिष्ट गुणों वाली स्पीशीज के रूप में विद्यमान होते हैं। परमाणुओं के ऐसे समूह को ‘अणु कहते हैं। प्रत्यक्ष रूप में कोई बल अणुओं के घटक परमाणुओं को आपस में पकड़े रहता है। वस्तुतः रासायनिक आबन्ध को इस प्रकार परिभाषित किया जा सकता हैविभिन्न रासायनिक स्पीशीज में उनके अनेक घटकों (परमाणुओं, आयनों इत्यादि) को संलग्न रखने वाले आकर्षण बल को ‘रासायनिक आबन्ध’ कहते हैं।”
कॉसेल-लूइस अवधारणा के अनुसार, परमाणुओं का संयोजन अर्थात् रासायनिक आबन्ध बनना संयोजी इलेक्ट्रॉनों के एक परमाणु से दूसरे परमाणु पर स्थानान्तरण के द्वारा अथवा संयोजी इलेक्ट्रॉनों के सहभाजन के द्वारा होता है। इस प्रक्रिया में परमाणु अपने संयोजकता कोश में अष्टक प्राप्त करते हैं। जैसे सोडियम क्लोराइड अणु में सोडियम परमाणु अपना एक संयोजी इलेक्ट्रॉन त्याग देता है तथा इस इलेक्ट्रॉन को क्लोरीन परमाणु ग्रहण कर लेता है। इस प्रकार इलेक्ट्रॉनों के स्थानान्तरण के द्वारा दोनों परमाणु अपने-अपने संयोजकता कोश में अष्टेक प्राप्त कर लेते हैं तथा दोनों के मध्य एक रासायनिक आबन्ध (विद्युत-संयोजी आबन्ध) स्थापित हो जाता है।
2. निम्नलिखित तत्वों के परमाणुओं के लूइस बिन्दु प्रतीक लिखिए- \[Mg,{\text{ }}Na,{\text{ }}B,{\text{ }}0,{\text{ }}N,{\text{ }}Br\].
उत्तर:
परमाणु | परमाणु क्रमांक | इलेक्ट्रॉनिक विन्यास | लूइस बिन्द प्रतीक |
\[\begin{array}{*{20}{l}} {Mg} \\ \; \\ {\;\;\;\;Na} \\ \; \\ {\;\;\;\;\;B} \\ \; \\ {\;\;\;\;\;O} \\ \; \\ {\;\;\;\;\;N} \\ \; \\ {\;\;\;\;\;Br} \end{array}\] | $12$ $11$ $5$ $8$ $7$ $35$ | $2,8,2$ $2,8,1$ $2,3$ $2,6$ $2,5$ $2,8,18,7$ | 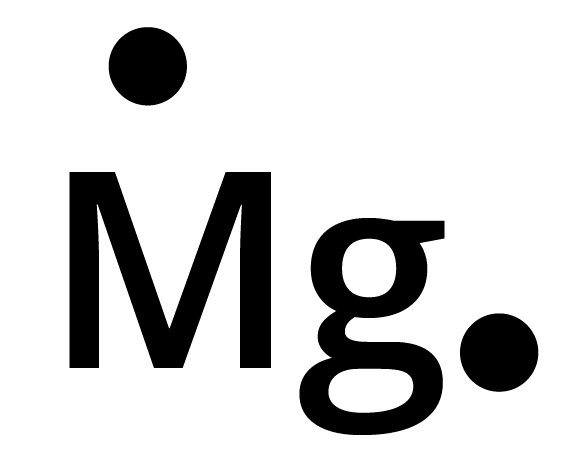





|
3. निम्नलिखित परमाणुओं तथा आयनों के लूइस बिन्दु प्रतीक लिखिए-
$S$ और ${S^{2 - }}$ , $Al$ तथा $A{l^{3 + }},H$ और \[{H^ - }\]
उत्तर:
परमाणु / आयन | उपस्थित कुल इलेक्ट्रॉन की संख्या | इलेक्ट्रॉन विन्यास | लूइस संकेत |
S S\[^{-2}\] 4AI Al\[^{3+}\] H H\[^{-}\] | $16$ $16 + 2 = 18$ $13$ $13 - 3 = 10$ $1$ $1 + 1 = 2$ | $2,8,6$ $2,8,8$ $2,8,3$ $2,3$
$1$ $2$ | 
|
4. निम्नलिखित अणुओं तथा आयनों की लूइस संरचनाएँ लिखिए-
\[{H_2}S,{\text{ }}SiC{l_4},{\text{ }}Be{F_2},C{O^{2 - }}{_3^ - },{\text{ }}HCOOH\]
उत्तर
![\[{H_2}S,{\text{ }}SiC{l_4},{\text{ }}Be{F_2},C{O^{2 - }}{_3^ - },{\text{ }}HCOOH\]](https://elitestealsonly.com/seo/content-images/d95381cd-9096-4678-909c-6552581cbba4.png)
5. अष्टक नियम को परिभाषित कीजिए तथा इस नियम के महत्त्व और सीमाओं को लिखिए।
उत्तर:
अष्टक नियम (Octet Rule)-वर्ग \[18\] में उपस्थित अक्रिय गैसों अथवा उत्कृष्ट गैस तत्वों • को शून्य वर्ग के तत्व भी कहा जाता है। इसका अर्थ है कि इनकी संयोजकता शून्य है अर्थात् इनके परमाणु स्वतन्त्र अवस्था में पाए जा सकते हैं। उत्कृष्ट गैस तत्वों के इलेक्ट्रॉनिक विन्यास निम्नांकित सारणी में दिए गए हैं-
सारणी -1 उत्कृष्ट गैसों के इलेक्ट्रॉनिक विन्यास | |||
तत्व | प्रतीक | परमाणु क्रमांक | इलेक्ट्रॉनिक विन्यास |
हीलियम निऑन आर्गन क्रिप्टॉन जीनॉन रेडॉन | He Ne Ar Kr Xe Rn | \[2\] \[10\] \[18\] \[36\] \[54\] | \[1{s^2}^\;\] \[1{s^2},2{s^2}\;2{p^6}\] \[\;1{s^2},2{s^2}\;2{p^6}\;,3{s^2}3{p^6}\] \[1{s^2},2{s^2}2{p^6},3{s^2}3{p^6}3{d^{10}}\;,4{s^2}4{p^6}\] \[1{s^2},2{s^2}2{p^6}\;,3{s^2}3{p^6}3{d^{10}},4{s^2}4{p^6}4{d^{10}}\;,5{s^2}5{p^6}\] \[1{s^2},2{s^2}\;2{p^6}\;,3{s^2}3{p^6}3{d^{10}}\;,4{s^2}\;4{p^6}4{d^{10}}4{f^{14}},5{s^2}5{p^6},5{d^{10}},6{s^2}6{p^6}\] |
प्रथम सदस्य हीलियम, जिसके संयोजी कोश में केवल दो इलेक्ट्रॉन हैं, के अतिरिक्त शेष सदस्यों के संयोजी कोश में आठ इलेक्ट्रॉन हैं। सन् \[1916\] में जी०एन० लूइस तथा कॉसेल ने ज्ञात किया कि उत्कृष्ट गैस तत्वों का स्थायित्व इनके संयोजी कोशों में आठ इलेक्ट्रॉनों (हीलियम को छोड़कर) अथवा पूर्ण अष्टक की उपस्थिति के कारण होता है। इनके अनुसार अन्य तत्वों के परमाणुओं के बाह्य कोश में आठ से कम इलेक्ट्रॉन होते हैं; अतः ये तत्व अपना आदर्श स्थायी रूप प्राप्त करने के प्रयत्न में रासायनिक संयोजनों में भाग लेते हैं जिससे वे इलेक्ट्रॉनों के आदान-प्रदान द्वारा अपने समीपवर्ती अक्रिय गैस के समान इलेक्ट्रॉनिक विन्यास ग्रहण कर सकें। इसे अष्टक नियम कहते हैं। वास्तव में इलेक्ट्रॉनों द्वारा रासायनिक आबन्धों के बनने की व्याख्या के लिए कई प्रयास किए गए, परन्तु कॉसेल तथा लुइस स्वतन्त्र रूप से सन्तोषजनक व्याख्या देने में सफल हुए। उन्होंने सर्वप्रथम संयोजकता की तर्क-संगत व्याख्या की। यह व्याख्या उपर्युक्त दी गई उत्कृष्ट गैसों की अक्रियता पर आधारित थी।
लूइस परमाणुओं को एक धन-आवेशित अष्टि (नाभिक तथा आन्तरिक इलेक्ट्रॉन युक्त) तथा बाह्य कक्षकों के रूप में निरूपित किया गया। बाह्य कक्षकों में अधिकतम आठ इलेक्ट्रॉन समाहित हो सकते हैं। उसने यह माना कि ये आठों इलेक्ट्रॉन घन के आठ कोनों पर उपस्थित हैं, जो केन्द्रीय अष्टि को चारों ओर से घेरे रहते हैं। इस प्रकार सोडियम के बाह्य कोश में उपस्थित एकल इलेक्ट्रॉन घन के एक कोने पर स्थित रहता है, जबकि उत्कृष्ट गैसों में घन के आठों कोनों पर एक-एक इलेक्ट्रॉन उपस्थित रहते हैं। लूइस ने यह अभिगृहीत दिया कि परमाणु परस्पर रासायनिक आबन्ध द्वारा संयुक्त होकर अपने स्थायी अष्टक को प्राप्त करते हैं। उदाहरण के लिए सोडियम एवं क्लोरीन में सोडियम अपने एक इलेक्ट्रॉन को क्लोरीन को सरलतापूर्वक देकर अपना स्थायी अष्टक प्राप्त करता है तथा क्लोरीन एक इलेक्ट्रॉन प्राप्त कर अपना स्थायी अष्टक निर्मित करता है, अर्थात् सोडियम ($N{a^ + }$ ) तथा क्लोरीन ($C{l^ - }$ ) आयन बनते हैं।
\[Na{\text{ }} \to {\text{ }}N{a^ + } + {e^ - }\]
\[Cl{\text{ }} + {\text{ }}{e^ - } \to {\text{ }}C{l^ - }\]
\[\;N{a^ + } + C{l^--} \to {\text{ }}NaCl\;or\;\;N{a^ + }C{l^--}\]
इस प्रकार कॉसेल तथा लूइस ने परमाणुओं के बीच रासायनिक संयोजन के एक महत्त्वपूर्ण सिद्धान्त को विकसित किया। इसे ‘रासायनिक आबन्धन का इलेक्ट्रॉनिकी सिद्धान्त’ कहा जाता है। इस सिद्धान्त के अनुसार-
परमाणुओं का संयोजन संयोजक इलेक्ट्रॉनों के एक परमाणु से दूसरे परमाणु पर स्थानान्तरण के द्वारा अथवा संयोजक इलेक्ट्रॉनों के सहभाजन (sharing) के द्वारा होता है।”
इस प्रक्रिया में परमाणु अपने संयोजकता कोश में अष्टक प्राप्त करते हैं।
अष्टक नियम का महत्त्व (Significance of Octet Rule)
अष्टक नियम अत्यन्त उपयोगी है। इसका महत्त्व निम्नवर्णित है-
1. अधिकांश अणु अष्टक नियम का अनुसरण करके ही निर्मित होते हैं; जैसे- \[{O_2},{\text{ }}{N_2},{\text{ }}C{l_2},B{r_2}\] आदि।
2. अधिकांश कार्बनिक यौगिकों की संरचनाओं को समझने में अष्टक नियम का अत्यधिक महत्त्व है।
3. इसे मुख्य रूप से आवर्त सारणी के द्वितीय आवर्त के तत्वों पर लागू किया जा सकता है।
अष्टक नियम की सीमाएँ (Limitations of Octet Rule) यद्यपि अष्टक नियम अत्यन्त उपयोगी है, परन्तु यह सदैव लागू नहीं किया जा सकता अर्थात् यह सार्वत्रिक (universal) नहीं है। अष्टक नियम के तीन प्रमुख अपवाद निम्नलिखित हैं-
(1) केन्द्रीय परमाणु का अपूर्ण अष्टक (Incomplete octet of central atom) - कुछ यौगिकों में केन्द्रीय परमाणु के चारों ओर उपस्थित इलेक्ट्रॉनों की संख्या आठ से कम होती है। यह मुख्यत: उन तत्वों के यौगिकों में होता है जिनमें संयोजकता इलेक्ट्रॉनों की संख्या चार से कम होती है। उदाहरण के लिए \[LiC{l_2},Be{H_2}\] तथा \[BC{l_3}\] के बनने में,
![\[LiC{l_2},Be{H_2}\] तथा \[BC{l_3}\]](https://elitestealsonly.com/seo/content-images/dcca6d2c-c894-46f1-97f8-16aa1a5f73ed.png)
$Li,Be,B$ के संयोजकता इलेक्ट्रॉनों की संख्या क्रमशः $1,2,3$ हैं। इस प्रकार के अन्य उदाहरण तथा ; हैं।
(2) विषम इलेक्ट्रॉन अणु (Odd electron molecule) - उन अणुओं, जिनमें इलेक्ट्रॉनों की कुल संख्या विषम (odd) होती है; जैसे-नाइट्रिक ऑक्साइड ($NO$ ) तथा नाइट्रोजन डाइऑक्साइड ($N{O_2}$ ) में सभी परमाणु अष्टक नियम का पालन नहीं कर पाते।

(3) प्रसारित अष्टक (Expanded octet) - आवर्त सारणी के तीसरे तथा इससे आगे के आवर्ती के तत्वों में आबन्धन के लिए \[35\] तथा \[3p - \] कक्षकों के अतिरिक्त \[3d - \] कक्षक भी उपलब्ध होते हैं। इन तत्वों के अनेक यौगिकों में केन्द्रीय परमाणु के चारों ओर आठ से अधिक इलेक्ट्रॉन होते हैं। इसे प्रसन्नरत अष्टक (expanded octet) कहते हैं। स्पष्ट है कि इन यौगिकों पर अष्टक नियम लागू नहीं होता है। ऐसे यौगिकों के कुछ उदाहरण हैं $P{F_5},S{F_6},{H_2}S{O_4}$ तथा कई उपसहसंयोजक यौगिक।
6. आयनिक आबन्ध बनाने के लिए अनुकूल कारकों को लिखिए।
उत्तर:
आयनिक आबन्ध बनाने के लिए अनुकूल कारक (Favourable Factors for lonic Bond formation) आयनिक आबन्ध बनाने के लिए निम्नलिखित कारक अनुकूल होते हैं
(1) आयनन एन्थैल्पी (Ionization enthalpy) - धनात्मक आयन या धनायन के बनने में किसी एक परमाणु को इलेक्ट्रॉनों का त्याग करना पड़ता है जिसके लिए आयनन एन्थैल्पी की आवश्यकता होती है। हम जानते हैं कि आयनन एन्थैल्पी ऊर्जा की वह मात्रा है जो किसी विलगित गैसीय परमाणु से बाह्यतम इलेक्ट्रॉन निकालने के लिए आवश्यक होती है; अत: आयनन एन्थैल्पी की जितनी कम आवश्यकता होगी, धनायन का निर्माण उतना ही सरल होगा। \[5 - \] ब्लॉक में उपस्थित क्षार धातुएँ एवं क्षारीय मृदा धातुएँ सामान्यत: धनायन बनाती हैं; क्योंकि इनकी आयनन एन्थैल्पी अपेक्षाकृत कम होती
(2) इलेक्ट्रॉन लब्धि एन्थैल्पी (Electron gain enthalpy) - धनायनों के निर्माण में मुक्त हुए। इलेक्ट्रॉन, आयनिक बन्ध के निर्माण में भाग ले रहे अन्य परमाणु द्वारा ग्रहण कर लिए जाते हैं। परमाणुओं की इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति इलेक्ट्रॉन लब्धि एन्थैल्पी पर निर्भर करती है। किसी विलगित गैसीय परमाणु द्वारा एक इलेक्ट्रॉन ग्रहण करके ऋणायन बनने में जितनी ऊर्जा विमुक्त होती है, इलेक्ट्रॉन लब्धि एन्थैल्पी कहलाती है। इस प्रकार स्पष्ट है कि इलेक्ट्रॉन लब्धि एन्थैल्पी के अधिक ऋणात्मक होने पर ऋणायन का निर्माण सरल होगा। वर्ग \[17\] में उपस्थित हैलोजेनों की ऋणायन बनाने की प्रवृत्ति सर्वाधिक होती है, क्योंकि इनकी इलेक्ट्रॉन लब्धि एन्थैल्पी अत्यन्त उच्च ऋणात्मक होती है। ऑक्सीजन परिवार (वर्ग \[16\] ) के सदस्यों में भी ऋणायन बनाने की प्रवृत्ति होती है, परन्तु अधिक सरलता से यह सम्भव नहीं होता; क्योंकि ऊर्जा की आवश्यकता द्विसंयोजी ऋणायन (${O^{2 - }}$ ) बनाने के लिए होती है।
(3) जालक ऊर्जा या एन्थैल्पी (Lattice energy or enthalpy) - आयनिक यौगिक क्रिस्टलीय ठोसों के रूप में होते हैं तथा आयनिक यौगिकों के क्रिस्टलों में धनायन तथा ऋणायन त्रिविमीय रूप में नियमित रूप से व्यवस्थित रहते हैं। चूंकि आयन आवेशित स्पीशीज हैं; अत: आयनों के आकर्षण में विमुक्त ऊर्जा जालक ऊर्जा या एन्थैल्पी कहलाती है। इसे इस प्रकार परिभाषित किया जा सकता है– विपरीत, आवेश वाले आयनों के संयोजन द्वारा जब क्रिस्टलीय ठोस का एक मोल प्राप्त होता है, तब विमुक्त ऊर्जा जालक ऊर्जा या एन्थैल्पी कहलाती है।”
इसे द्वारा व्यक्त किया जाता है।
\[{A^ + }\left( g \right) + {\text{ }}{B^--}\left( g \right){\text{ }}{A^ + }{B^--}\left( s \right) + \left( U \right)\]
इस प्रकार स्पष्ट है कि जालक ऊर्जा का परिमाण अक्कि होने पर आयनिक बन्ध अथवा आयनिक यौगिक का स्थायित्व अधिक होगा।
निष्कर्षत: यदि जालक ऊर्जा का परिमाण तथा ऋणात्मक इलेक्ट्रॉन लब्धि एन्थैल्पी आवश्यक आयनन एन्थैल्पी की तुलना में अधिक होंगे, तब एक स्थायी रासायनिक बन्ध प्राप्त होगा। इनके कम होने पर बन्ध का विरचन नहीं होगा।
7. निम्नलिखित अणुओं की आकृति की व्याख्या ‘वी०एसईपी०आर० सिद्धान्त के अनुरूप कीजिए-
\[{\mathbf{BeC}}{{\mathbf{l}}_{\mathbf{2}}},{\text{ }}{\mathbf{BC}}{{\mathbf{l}}_{\mathbf{3}}},{\text{ }}{\mathbf{SiC}}{{\mathbf{l}}_{\mathbf{4}}},{\text{ }}{\mathbf{As}}{{\mathbf{F}}_{\mathbf{5}}},{\text{ }}{{\mathbf{H}}_{\mathbf{2}}}{\mathbf{S}},{\text{ }}{\mathbf{P}}{{\mathbf{H}}_{\mathbf{3}}}\]
उत्तर:
$BeC{l_2}$ : केन्द्रीय \[Be\] परमाणु में केवल \[2\] आबन्धः युग्म हैं तथा कोई एकाकी युग्म नहीं (\[Cl:{\text{ }}Be{\text{ }}:C\] ) है। अत: इसकी आकृति रेखीय (linear) होगी।
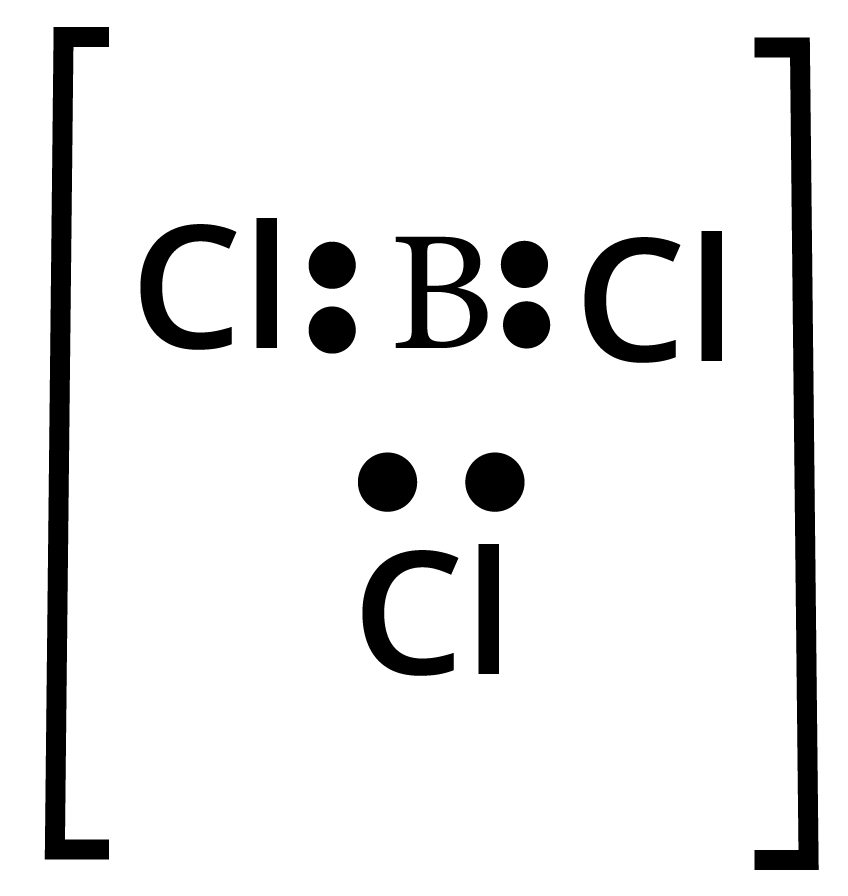
$BC{l_3}$ : केन्द्रीय बोरोन परमाणु में केवल \[3\] बन्ध युग्म हैं तथा कोई एकाकी युग्म नही है। अत: इसकी आकृति त्रिकोणीय समतलीय (trigonal planar) होगी।
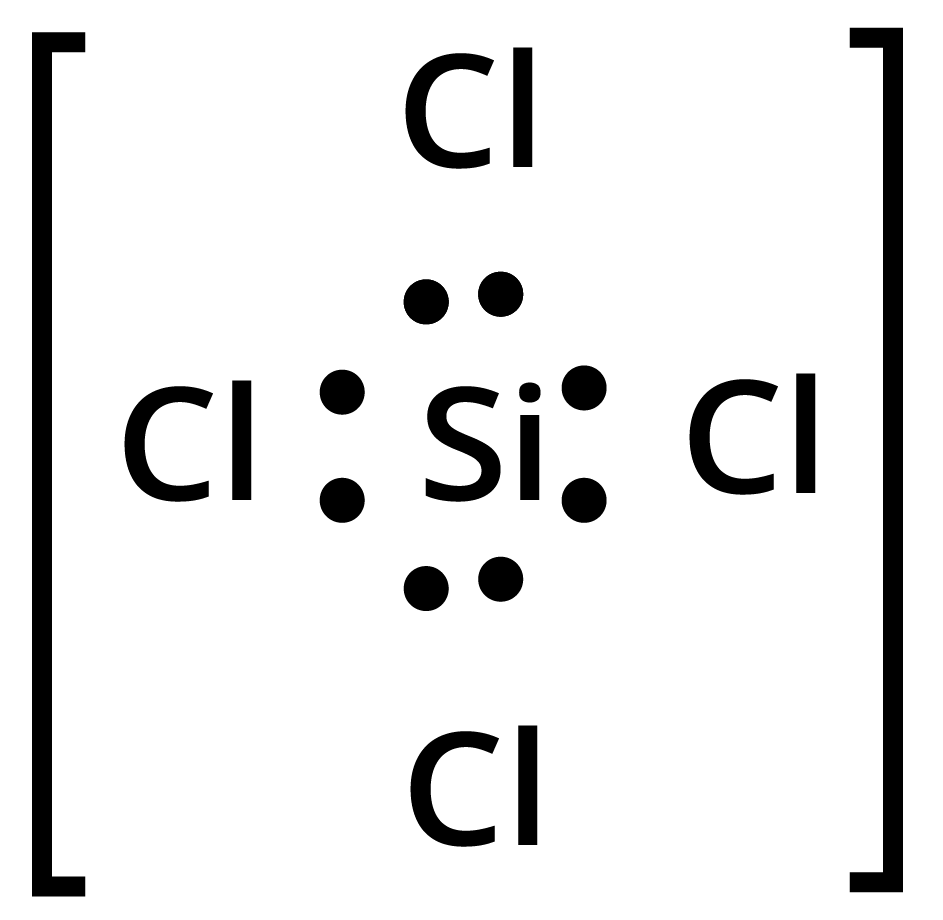
$SiC{l_4}$ : केन्द्रीय सिलिकॉन परमाणु में \[4\] आबन्ध युग्म हैं तथा कोई एकाकी युग्म नहीं है। अत: इसकी आकृति चतुष्फलकीय (tetrahedral) होगी।
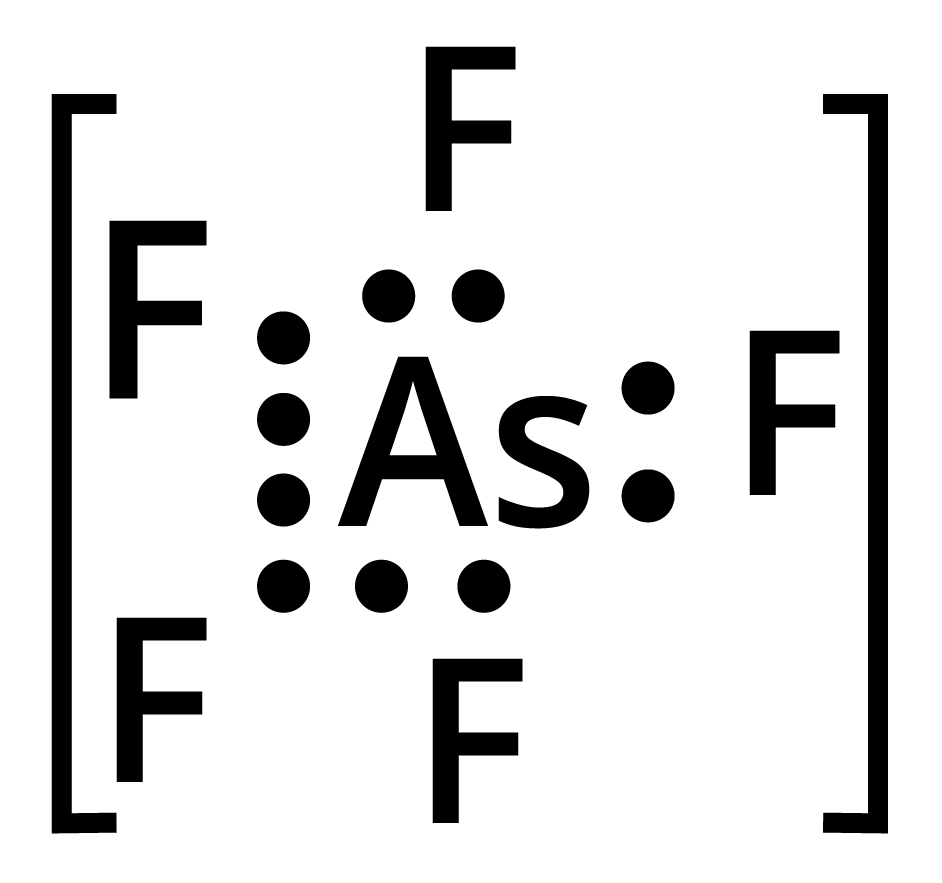
\[As{F_5}\] : केन्द्रीय ऑसेनिक परमाणु में आबन्ध युग्म हैं तथा कोई एकाकी युग्म नहीं है। अत: इसकी आकृति त्रिभुजाकार द्विपिरामिडीय है।
${H_2}S$ : केन्द्रीय सल्फर परमाणु में \[2\]आबन्ध युग्म हैं तथा कोई एकाकी युग्म नहीं है। अतः इसकी आकृति बंकित (bent) होगी।

$P{H_3}$ : केन्द्रीय फॉस्फोरस परमाणु में आबन्ध युग्म हैं और एक एकाकी युग्म है। अत: इसकी आकृति त्रिकोणीय समतलीय (trigonal planar) होगी।
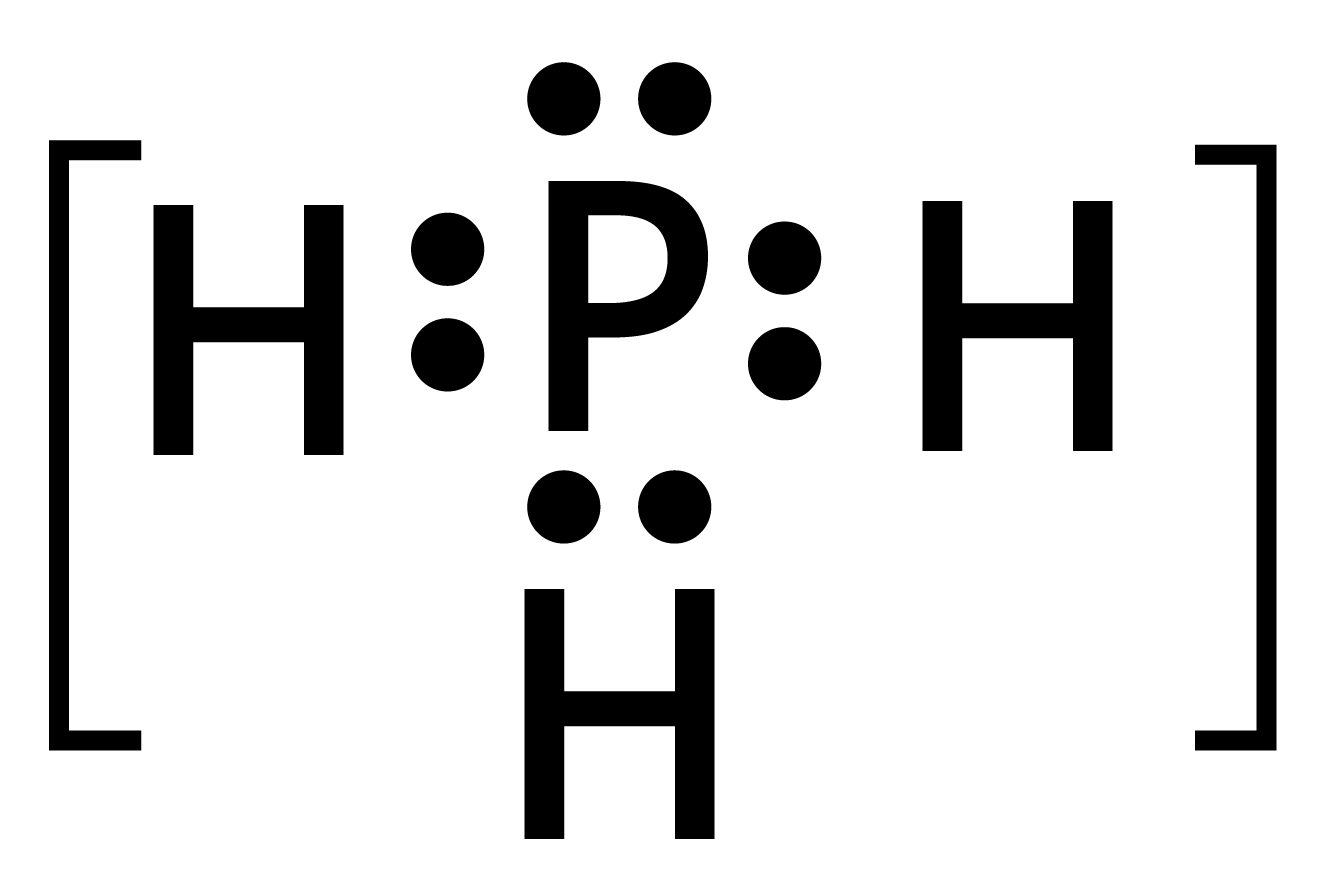
8. यद्यपि $N{H_3}$ तथा ${H_2}O$ दोनों अणुओं की ज्यामिति विकृत चतुष्फलकीय होती है, तथापि जल में आबन्ध कोण अमोनिया की अपेक्षा कम होता है। विवेचना कीजिए।
उत्तर:
अणु में नाइट्रोजन परमाणु पर एक एकाकी इलेक्ट्रॉन युग्म, जबकि ${H_2}O$ अणु में ऑक्सीजन परमाणु पर दो एकाकी इलेक्ट्रॉन युग्म उपस्थित हैं। VSEPR सिद्धान्त के अनुसार, हम जानते हैं कि इलेक्ट्रॉन युग्मों के बीच प्रतिकर्षण अन्योन्यक्रियाएँ निम्नलिखित क्रम में घटती हैं-
एकाकी युग्म-एकाकी युग्म > एकाकी युग्म-आबन्धी युग्म > आबन्धी युग्म-आबन्धी युग्म
या \[lp - lp > {\text{ }}lp - bp > {\text{ }}bp{\text{ }}--{\text{ }}bp\]
ऑक्सीजन परमाणु के पास अधिकं एकाकी इलेक्ट्रॉन युग्म होने के कारण \[{H_2}O\] में \[O---H\] आबन्ध-युग्म, $N{H_3}$ में $N - H$ आबन्ध युग्मों की अपेक्षा अधिक निकट होते हैं; अत: $N{H_3}$ में आबन्ध कोण ( \[107^\circ \]) \[{H_2}O\] के आबन्ध कोण (\[104.5^\circ \]) से अधिक होता है।
9. आबन्ध प्रबलता को आबन्ध कोटि के रूप में आप किस प्रकार व्यक्त करेंगे?
उत्तर:
यदि आबन्ध विघटन एन्थैल्पी (bond dissociation enthalpy) अधिक है तो आबन्ध अधिक प्रबल होगा तथा आबन्ध कोटि बढ़ने पर आबन्ध एन्थैल्पी बढ़ती है। इस तथ्य से स्पष्ट हैं कि आबन्ध प्रबलता तथा आबन्ध कोटि परस्पर समानुपाती होते हैं। अत: आबन्ध कोटि बढ़ने पर, आबन्ध प्रबलता भी अधिक होगी। उदाहरणार्थ- \[{N_2}\] की आबन्ध कोटि \[3\] है तथा इसकी आबन्ध एन्थैल्पी \[945{\text{ }}kJ{\text{ }}mo{l^{ - 1}}\] है। इसी प्रकार ${O_2}$ की आबन्ध कोटि \[2\] है तथा इसकी आबन्ध एन्थैल्पी \[498kJmo{l^{ - 1}}\] है। इनमें N, आबन्ध अधिक प्रबल होगा।
10. आबन्ध-लम्बाई की परिभाषा दीजिए।
उत्तर:
किसी अणु में आबन्धित परमाणुओं के नाभिकों के बीच साम्यावस्था दूरी आबन्ध-लम्बाई कहलाती है। आबन्ध-लम्बाई के मान सामान्यत: पिकोमीटर (\[1{\text{ }}pm = {\text{ }}{10^{ - 12}}m\] ) में व्यक्त किए जाते है।
आयनिक यौगिकों में दो आबन्धित परमाणुओं के मध्य आबन्ध-लम्बाई उनकी आयनिक त्रिज्याओं को जोड़कर प्राप्त की जाती है। इसी प्रकार सहसंयोजी यौगिकों में दो आबन्धित परमाणुओं के मध्य आबन्ध-लम्बाई उनकी सहसंयोजी (परमाणु) त्रिज्या जोड़कर प्राप्त की जाती है।
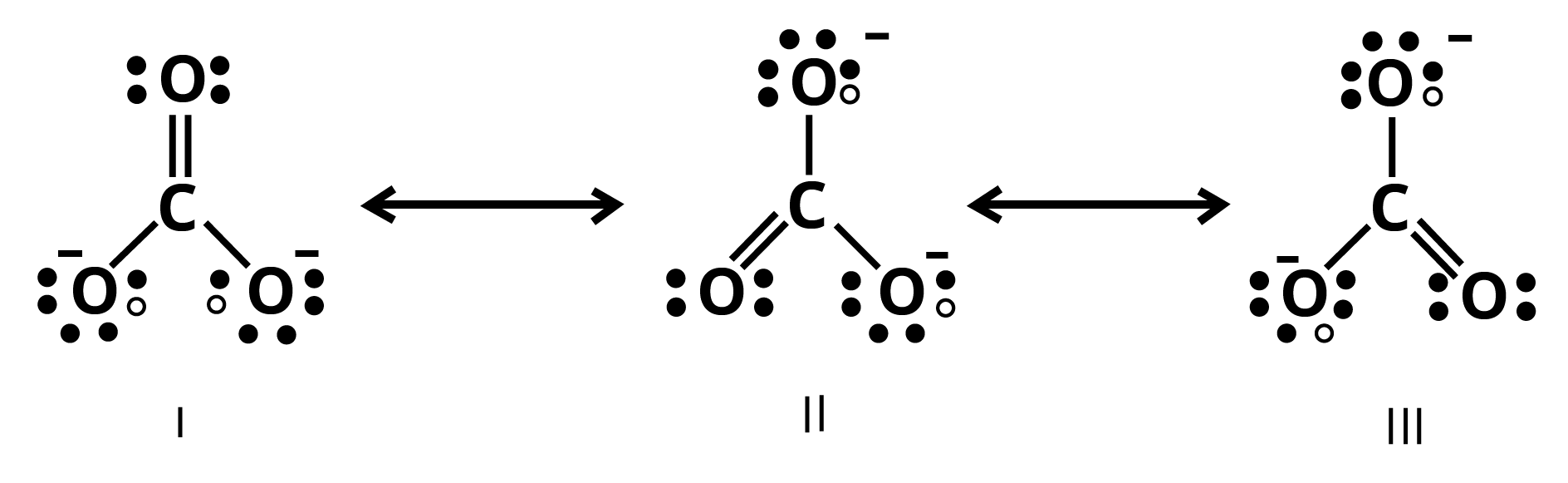
11. $CO_3^{2 - }$ आयन के सन्दर्भ में अनुनाद के विभिन्न पहलुओं को स्पष्ट कीजिए।
उत्तर:
कार्बन तथा ऑक्सीजन परमाणुओं के मध्य दो एकल आबन्ध तथा एक द्वि-आबन्ध वाली लूइस संरचना कार्बोनेट आयन की वास्तविक संरचना को निरूपित करने के लिए अपर्याप्त है; क्योंकि इसके अनुसार तीन कार्बन-ऑक्सीजन आबन्धों की लम्बाई भिन्न होनी चाहिए। परन्तु प्रायोगिक परिणामों के अनुसार कार्बोनेट आयन के तीनों कार्बन-ऑक्सीजन आबन्धों की लम्बाई समान होती है। अत: कार्बोनेट आयन की वास्तविक संरचना को निम्नलिखित तीन विहित संरचनाओं (I, II तथा III) के अनुनाद संकर के रूप में दर्शाया जा सकता है-
12. नीचे दी गई संरचनाओं (\[1\] तथा \[2\]) द्वारा ${H_3}P{O_3}$ को प्रदर्शित किया जा सकता है। क्या ये दो संरचनाएँ ${H_3}P{O_3}$ के अनुनाद संकर के विहित (केनॉनीकल) रूप माने जा सकते हैं? यदि नहीं तो उसका कारण बताइए।
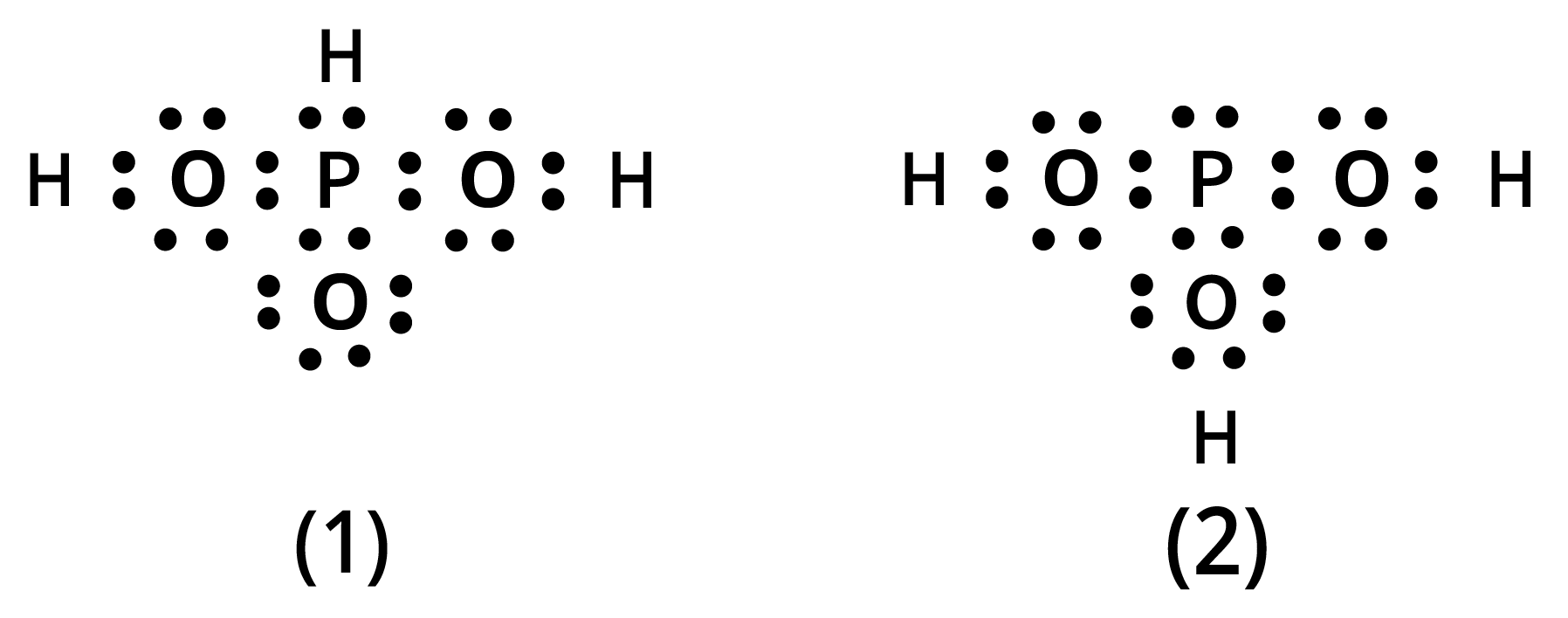
उत्तर:
दी गई संरचनाओं (\[1\]) तथा (\[2\]) में हाइड्रोजन परमाणु की स्थिति समान नहीं है। परमाणुओं की स्थिति में परिवर्तन होने के कारण, ये ${H_3}P{O_3}$ के अनुनाद संकर के विदित (केनॉनीकल) रूप नहीं माने जा सकते हैं।
13. \[S{O_3},N{O_2},NO_3^ - \], की अनुनाद संरचनाएँ लिखिए।
उत्तर:
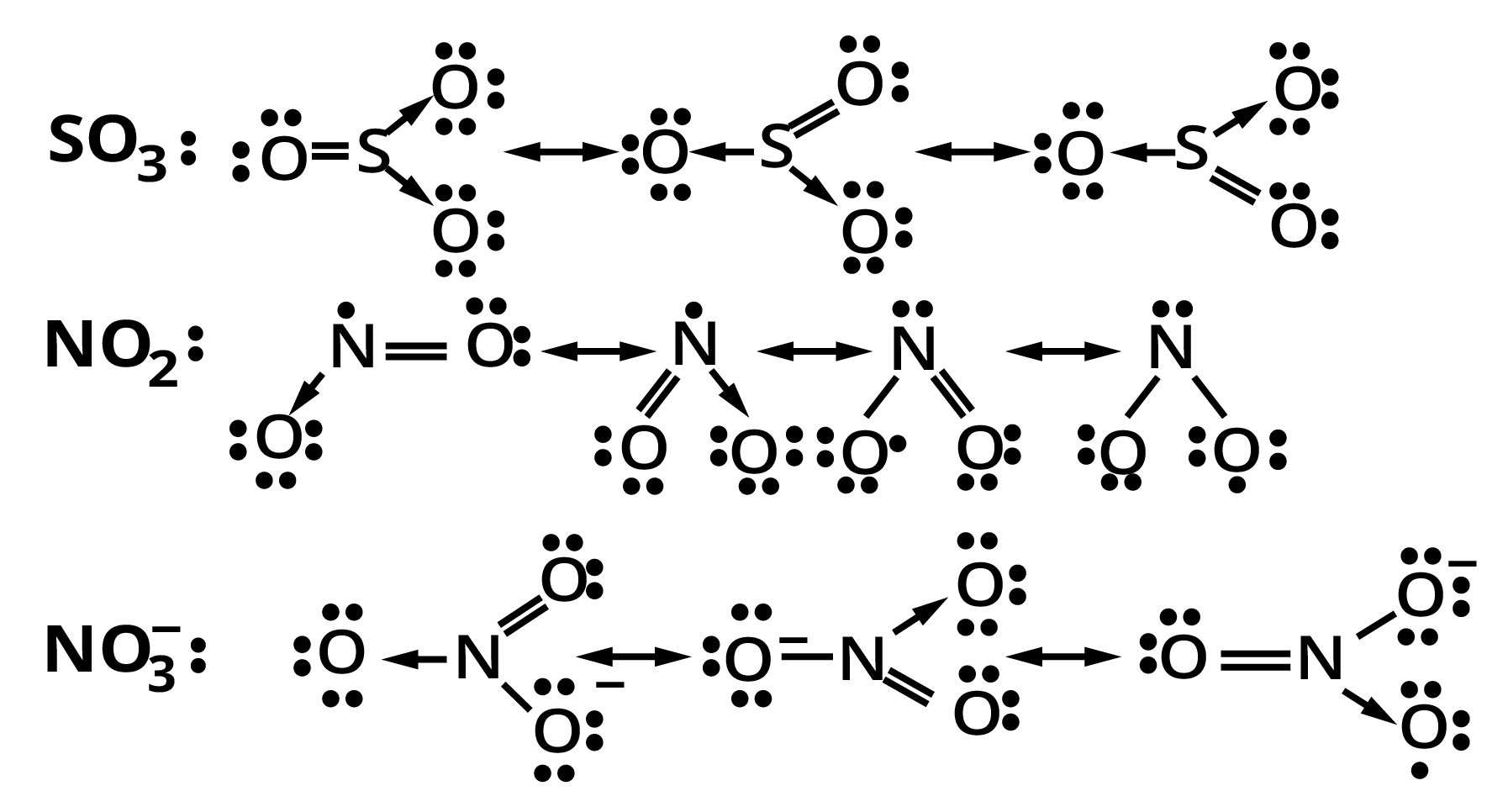
14. निम्नलिखित परमाणुओं से इलेक्ट्रॉन स्थानान्तरण द्वारा धनायनों तथा ऋणायनों में विरचन को लूइस बिन्दु-प्रतीकों की सहायता से दर्शाइए-
(क) $K$ तथा $S$
उत्तर:
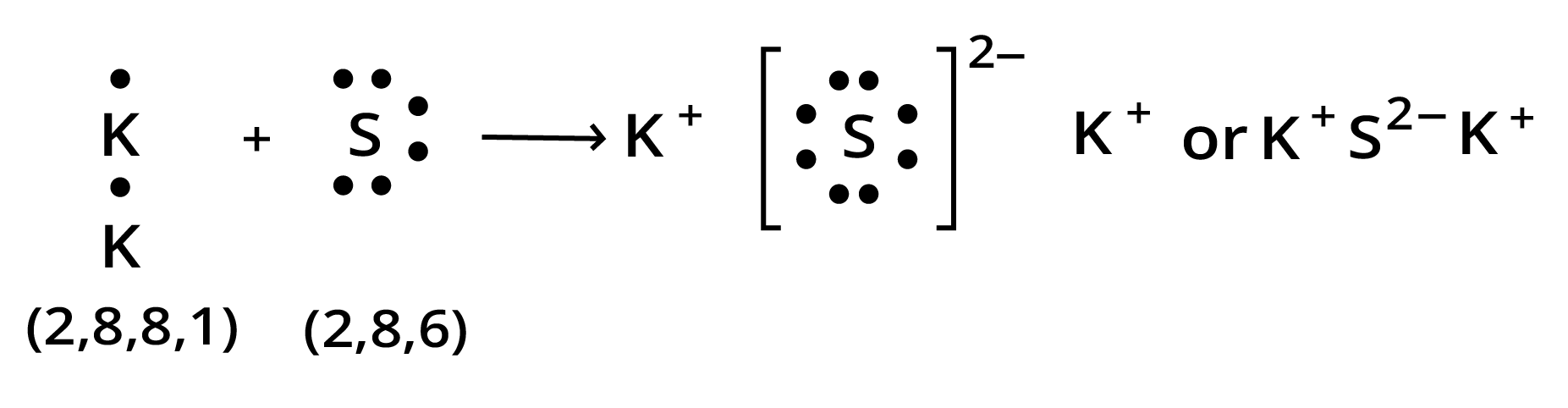
(ख) $Ca$ तथा $O$
उत्तर:
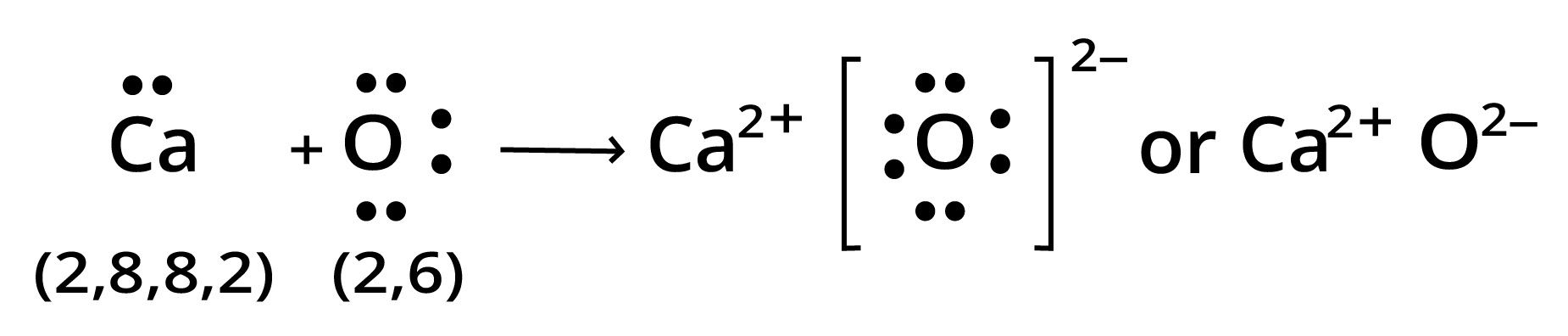
(ग) $Al$ तथा $N$
उत्तर:
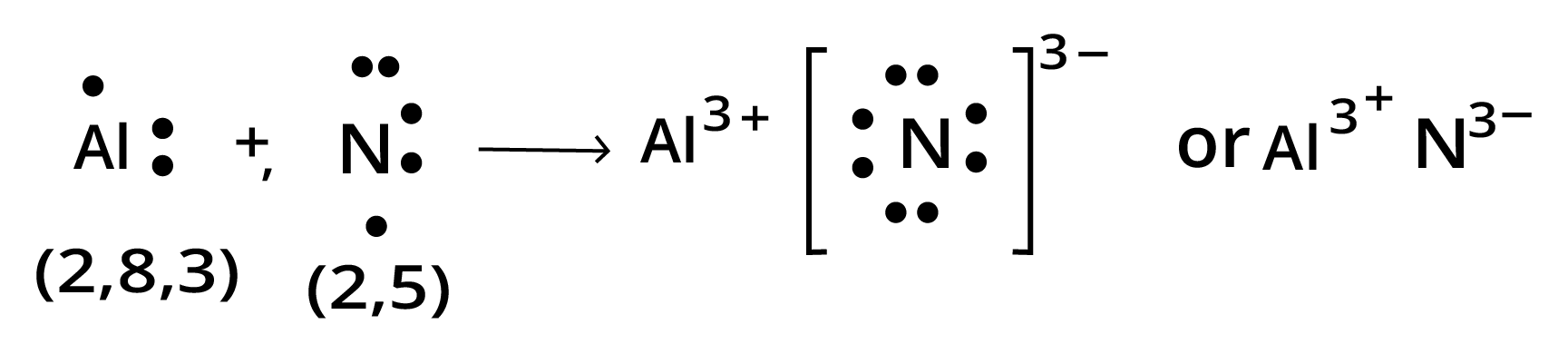
15. हालाँकि $C{O_2}$ तथा ${H_2}O$ दोनों त्रिपरमाणुक अणु हैं, परन्तु ${H_2}O$ अणु की आकृति बंकित होती है, जबकि $C{O_2}$ की रैखिक आकृति होती है। द्विध्रुव आघूर्ण के आधार पर इसकी व्याख्या कीजिए।
उत्तर:
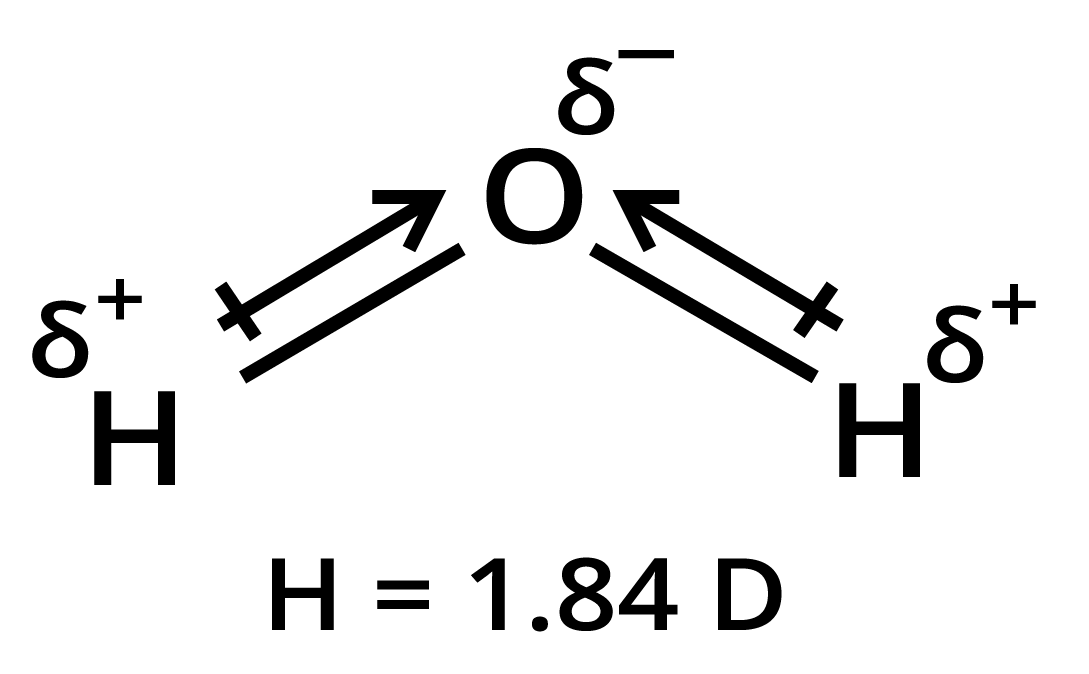
${H_2}O$ अणु -${H_2}O$ अणु का द्विध्रुव आघूर्ण $1.84\;D$ होता है। ${H_2}O$ अणु में दो \[OH\] आबन्ध होते हैं। ये $O - H$ आबन्ध ध्रुवी होते हैं तथा इनका द्विध्रुव आघूर्ण $1.5\;D$ होता है। चूंकि जल-अणु में परिणामी द्विध्रुव होता है; अत: दोनों \[OH\]-द्विध्रुव एक सरल रेखा में नहीं होंगे तथा एक-दूसरे को समाप्त नहीं करेंगे। इस प्रकार ${H_2}O$ अणु की रैखिक संरचना नहीं होती। ${H_2}O$ अणु में आबन्ध परस्पर एक निश्चित कोण पर स्थित होते हैं अर्थात् $H,O$ अणु की कोणीय संरचना होती है।
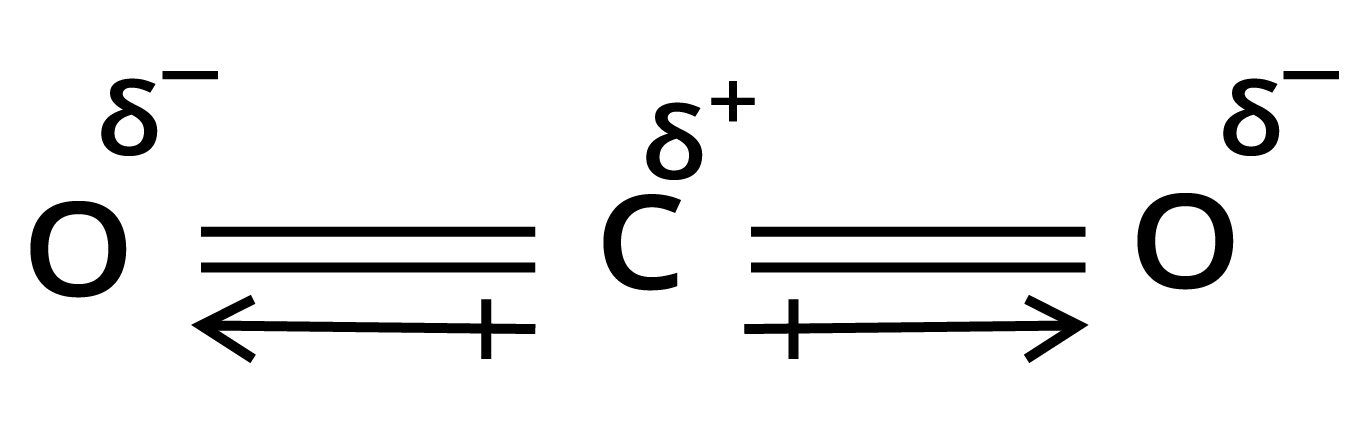
$C{O_2}$ अणु - $C{O_2}$ अणु का द्विध्रुव आघूर्ण शून्य होता है। $C{O_2}$ अणु में दो $C = O$ आबन्ध होते हैं। प्रत्येक आबन्ध एक ध्रुवी आबन्ध है। इसका अर्थ है कि प्रत्येक आबन्ध में द्विध्रुव आघूर्ण होता है। चूंकि $C{O_2}$ अणु का परिणामी द्विध्रुव आघूर्ण शून्य होता है; अतः दोनों आबन्ध द्विध्रुव अर्थात् दोनों आबन्ध एक-दूसरे के विपरीत होने चाहिए अर्थात् दोनों आबन्ध :एक-दूसरे से \[180^\circ \] पर स्थित होने चाहिए। इस प्रकार स्पष्ट है कि $C{O_2}$ अणु की संरचना रैखिके होती है।
16. द्विध्रुव आघूर्ण के महत्त्वपूर्ण अनुप्रयोग बताइए।
उत्तर:
द्विध्रुव आघूर्ण के महत्त्वपूर्ण अनुप्रयोग (Important Applications of Dipole Moment) द्विध्रुव-आघूर्ण के कुछ महत्त्वपूर्ण अनुप्रयोग निम्नलिखित हैं-
(1) अणुओं की प्रकृति ज्ञात करना (Predicting the nature of the molecules)–एक निश्चित द्विध्रुव आघूर्ण वाले अणु प्रकृति में ध्रुवी होते हैं, जबकि शून्य द्विध्रुव आघूर्ण वाले अणु अध्रुवी होते हैं। अत: \[Be{F_2}\] (\[\mu {\text{ }} = {\text{ 0}}D\]) अध्रुवी है, जबकि ${H_2}O$ (\[\mu {\text{ }} = {\text{ 1}}{\text{.84 }}D\]) ध्रुवी होता है।
(2) अणुओं की आण्विक संरचना ज्ञात करना (Predicting the molecular structure of the molecules)-हम जानते हैं कि परमाणुक गैसें; जैसे–अक्रिय गैसों आदि का द्विध्रुव आघूर्ण शून्य होता है, अर्थात् ये अधूवी हैं, परन्तु द्वि-परमाणुक अणु ध्रुवीय तथा अध्रुवीय होते हैं; जैसे ${H_2}{O_2}$ आदि अध्रुवी हैं (\[\mu {\text{ }} = {\text{ 0}}D\]) तथा $CO$ ध्रुवीय है। इन अणुओं की संरचना भी रैखिक होती है।
त्रिपरमाणुक अणु भी ध्रुवीय तथा अध्रुवीय होते हैं। $C{O_2},C{S_2}$ आदि अध्रुवी होते हैं; क्योंकि इनके लिए \[\mu {\text{ }} = {\text{ 0}}D\] होते हैं; अत: इन अणुओं की संरचना रैखिक होती है जिनको निम्नांकित प्रकार से प्रदर्शित कर सकते हैं-
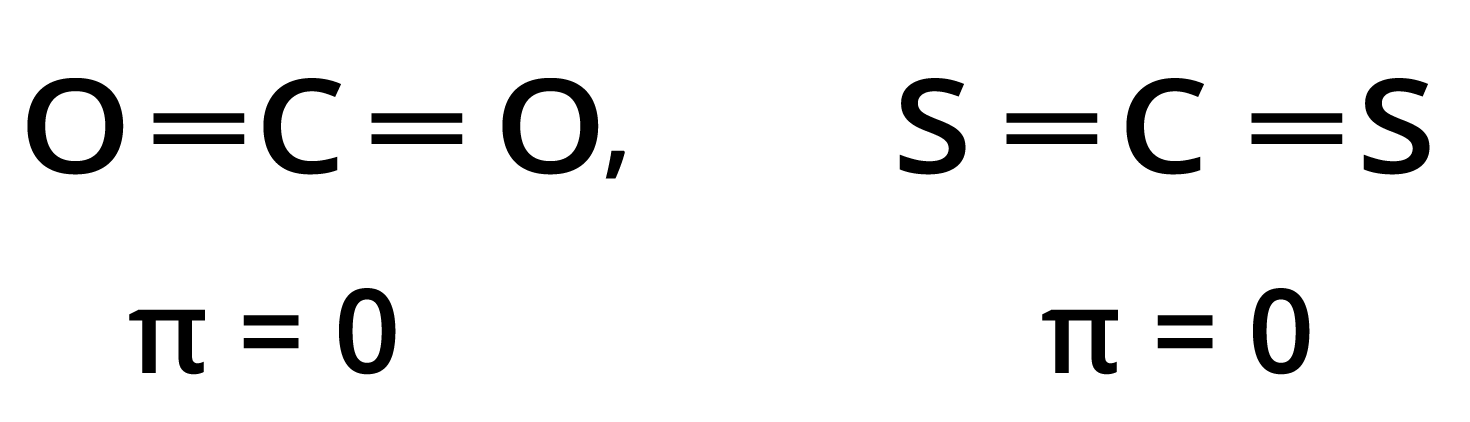
जल अणु ध्रुवी है, क्योंकि \[\mu {\text{ }} = {\text{184}}D\] होता है; अत: इसकी संरचना रैखिक नहीं हो सकती है। इसकी कोणीय संरचना होती है तथा प्रत्येक $O - H$ बन्ध के मध्य \[104^\circ 5\prime \] का कोण होता है। इसी प्रकार ${H_2}S,S{O_2}$ की भी कोणीय संरचनाएँ हैं; क्योंकि इनके लिए के मान क्रमशः \[0.90{\text{ }}D\] व \[1.71{\text{ }}D\] हैं।।
चार परमाणुकता वाले अणु भी ध्रुवीय तथा अध्रुवीय होते हैं। $BC{l_3}$ अणु के लिए \[\mu {\text{ }} = 0D\] होता है अर्थात् अध्रुवीय होता है। अतः इसकी संरचना समद्विबाहु त्रिभुज के समान होती है।
(3) आबन्धों की धुवणता ज्ञात करना (Determining the polarity of the bonds)– सहसंयोजी आबन्धयुक्त यौगिक में आयनिक गुण या ध्रुवणता उस बन्ध के निर्माण में प्रयुक्त तत्वों के परमाणुओं की विद्युत-ऋणात्मकता पर निर्भर करता है। इस प्रकार, आबन्ध की ध्रुवणता ∝ आबन्ध के परमाणुओं की विद्युत-ऋणात्मकता में अन्तर तथा द्विध्रुव आघूर्ण ∝ आबन्ध के परमाणुओं की विद्युत-ऋणात्मकता में अन्तर
∴ आबन्ध की ध्रुवणता ∝ द्विध्रुव आघूर्ण (μ)
उदाहरणार्थ- \[HE,{\text{ }}HCl,{\text{ }}HBr,{\text{ }}HI\] के द्विध्रुव आघूर्ण क्रमशः \[1.94D,{\text{ }}1.03{\text{ }}D,{\text{ }}0.68D\] व \[0.34D\] हैं; क्योंकि इनमें हैलोजेन की विद्युत-ऋणात्मकता का क्रम \[F{\text{ }} > {\text{ }}Cl > {\text{ }}Br > {\text{ }}I\] है। अतः आबन्धों में विद्युत-ऋणात्मकता अन्तर \[H---F{\text{ }} > {\text{ }}H - Cl > {\text{ }}H - Br > {\text{ }}H - I\] है। इससे प्रकट होता है कि इन आबन्धों की ध्रुवणता फ्लुओरीन से आयोडीन की ओर चलने से घटती है।
(4) आबन्धों में आयनिक प्रतिशतता ज्ञात करना (Determining the ionic percentage of the bonds)–द्विध्रुव आघूर्ण मान, ध्रुवी आबन्धों की आयनिक प्रतिशतता ज्ञात करने में सहायता प्रदान करते हैं। यह प्रेक्षित द्विध्रुव आघूर्ण अथवा प्रायोगिक रूप से निर्धारित द्विध्रुव आघूर्ण से सम्पूर्ण इलेक्ट्रॉन-स्थानान्तरण के द्विध्रुव आघूर्ण (सैद्धान्तिक) का अनुपात होता है। उदाहरणार्थ- \[HCl\] अणु का प्रेक्षित द्विध्रुव आघूर्ण \[1.04{\text{ }}D\] है। यदि $H - Cl$ आबन्ध में इलेक्ट्रॉन युग्म एक ओर हो तो इसका द्विध्रुव आघूर्ण (सैद्धान्तिक) \[q \times d\] के सूत्र से ज्ञात किया जा सकता है। $q$ का मान \[4.808 \times {10^{ - 10}}esu\] तथा $H$ व \[Cl\] के मध्य बन्ध-लम्बाई \[1.266{\text{ }} \times {\text{ }}{10^{ - 8}}cm\] पाई गई है।
सैद्धान्तिक $\mu = 4.808 \times {10^{ - 10}} \times 1.266 \times {10^{ - 8}}{\text{ esu - cm }} = 6.079{\text{D}}$
आबन्ध की आयनिक प्रतिशतता= प्रेक्षित द्विध्रुव आघूर्ण /सैद्धान्तिक द्विध्रुव आघूर्ण $ \times 100$
$\qquad = \dfrac{{1.04{\text{D}}}}{{6.079{\text{D}}}} \times 100 = 17.1\% $
अतः व के बीच सहसंयोजक आबन्ध विद्युत संयोजक है अर्थात् आयनिक है।
17. विद्युत-ऋणात्मकता की परिभाषित कीजिए। यह इलेक्ट्रॉन बन्धुता से किस प्रकार भिन्न है?
उत्तर:
विद्युत-ऋणात्मकता (Electronegativity)-किसी तत्व की विद्युत-ऋणात्मकता को इस प्रकार परिभाषित किया जा सकता है कि इसके परमाणु की सहसंयोजक आबन्ध में साझे के इलेक्ट्रॉन-युग्म को अपनी ओर आकर्षित करने की प्रवृत्ति की माप, तत्व की विद्युत-ऋणात्मकता कहलाती है।
विद्युत-ऋणात्मकता तथा इलेक्ट्रॉन-लब्धि एन्थैल्पी या इलेक्ट्रॉन बन्धुता में अन्तर निम्नलिखित हैं-
क्रम संख्या | इलेक्ट्रॉन बंधुता | विद्युत् ऋणात्मकता |
1 2 3 4 | यह परमाणु की ब्राहा इलेक्ट्रॉनों को आकर्षित करने की प्रवृति है। यह परमाणु की इलेक्ट्रॉनों आकर्षित करने की परम प्रवृति है। यह विलगित परमाणु का एक गुण है। इसकी निश्चित विशिष्ट इकाई (kj mol-1 तथा eV/atom ) होती है। | यह परमाणु की साझे इलेक्ट्रॉन-युग्म को आकर्षित करने की प्रवृति है। यह इलेक्ट्रॉन आकर्षित करने की सापेक्षकीय प्रवृति है। यह आबन्धित परमाणु का गुण है। इसकी कोई इकाई नहीं होती। इसकी तुलनात्मक गणना हेतु अनेक पैमाने (scales)उपलब्ध है। |
18. ध्रुवीय सहसंयोजी आंबन्ध से आप क्या समझते हैं? उदाहरण सहित व्याख्या कीजिए।
उत्तर:
ध्रुवीय सहसंयोजी यौगिक (Polar covalent compound)—बहुत-से अणुओं में एक परमाणु दूसरे परमाणु से अधिक ऋण-विद्युतीय होता है तो इसकी प्रवृत्ति सहसंयोजी बन्ध के इलेक्ट्रॉन युग्म को अपनी ओर खींचने की होती है, इसलिए वह इलेक्ट्रॉन युग्म सही रूप से अणु के केन्द्र में नहीं रहता है, बल्कि अधिक ऋण विद्युती तत्व के परमाणु की ओर आकर्षित रहता है। इस कारण एक . परमाणु पर धन आवेश (जिसकी ऋण-विद्युतीयता कम है) तथा दूसरे परमाणु पर ऋण आवेश (जिसकी ऋण-विद्युतीयता अधिक होती है) उत्पन्न हो जाता है। इस प्रकार प्राप्त अणु ध्रुवीय सहसंयोजी यौगिक कहलाता है और उसमें उत्पन्न बन्ध ध्रुवीय सहसंयोजी आबन्ध कहलाता है।
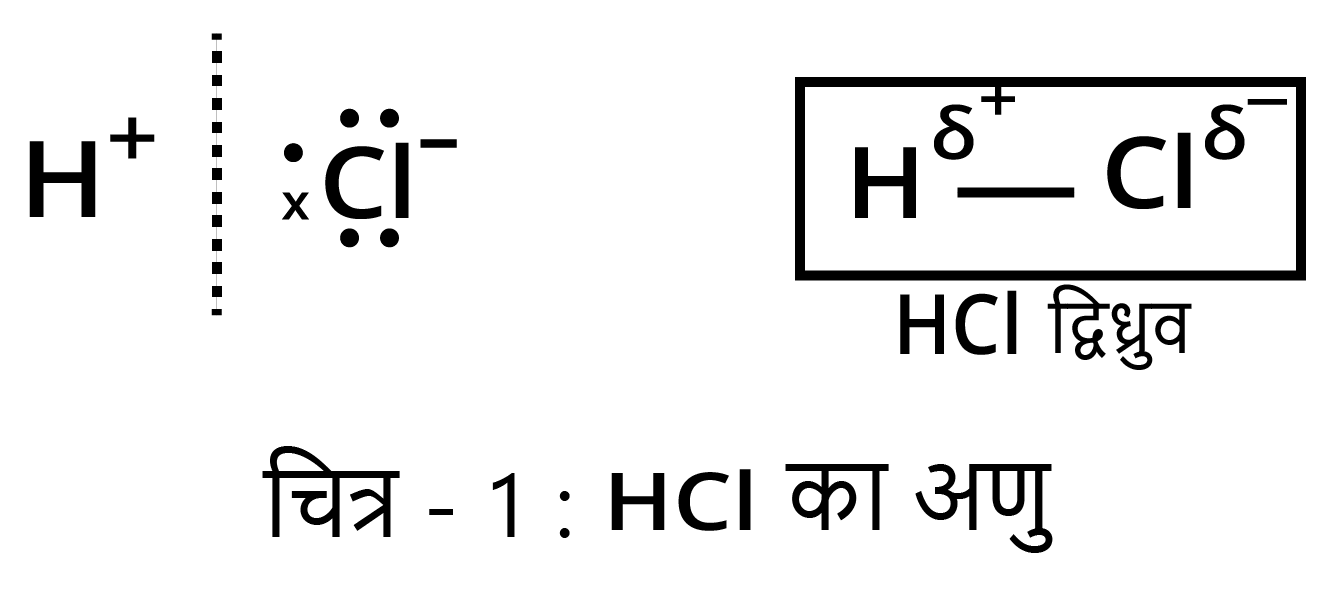
उदाहरण - $HCl$ अणु का बनना—क्लोरीन की विद्युत-ऋणात्मकता हाइड्रोजन की अपेक्षा अधिक है; अत: साझे का इलेक्ट्रॉन युग्म $Cl$ परमाणु के अत्यन्त निकट होता है। फलस्वरूप $H$ पर धन आवेश तथा $Cl$ पर ऋण आवेश आ जाता है तथा $HCl$ ध्रुवीय यौगिक की भाँति कार्य करने लगता है; अत: यह ध्रुवीय सहसंयोजी यौगिक का उदाहरण है।
19. निम्नलिखित अणुओं को आबन्धों की बढ़ती आयनिक प्रकृति के क्रम में लिखिए- \[LiF,{\text{ }}{K_2}0,{\text{ }}{N_2},{\text{ }}S{O_2}{\text{, }}Cl{F_2}.\]
उत्तर:
सामान्यतः, संयोग करने वाले परमाणुओं की विद्युत ऋणात्मकताओं में जितना अधिक अन्तर होगा, अणु में उतने ही अधिक आयनिक लक्षण होंगे। अणु की आकृति भी इस सम्बन्ध में महत्त्वपूर्ण है। दिये गये अणुओं का आयनिक प्रकृति के आधार पर क्रम निम्न है-
\[{N_2} < S{O_2} < Cl{F_2} < {F_2}O\]
$Cl{F_3}$ का $S{O_2}$ की तुलना में अधिक आयनिक होना इसकी $T$ आकृति के कारण है।
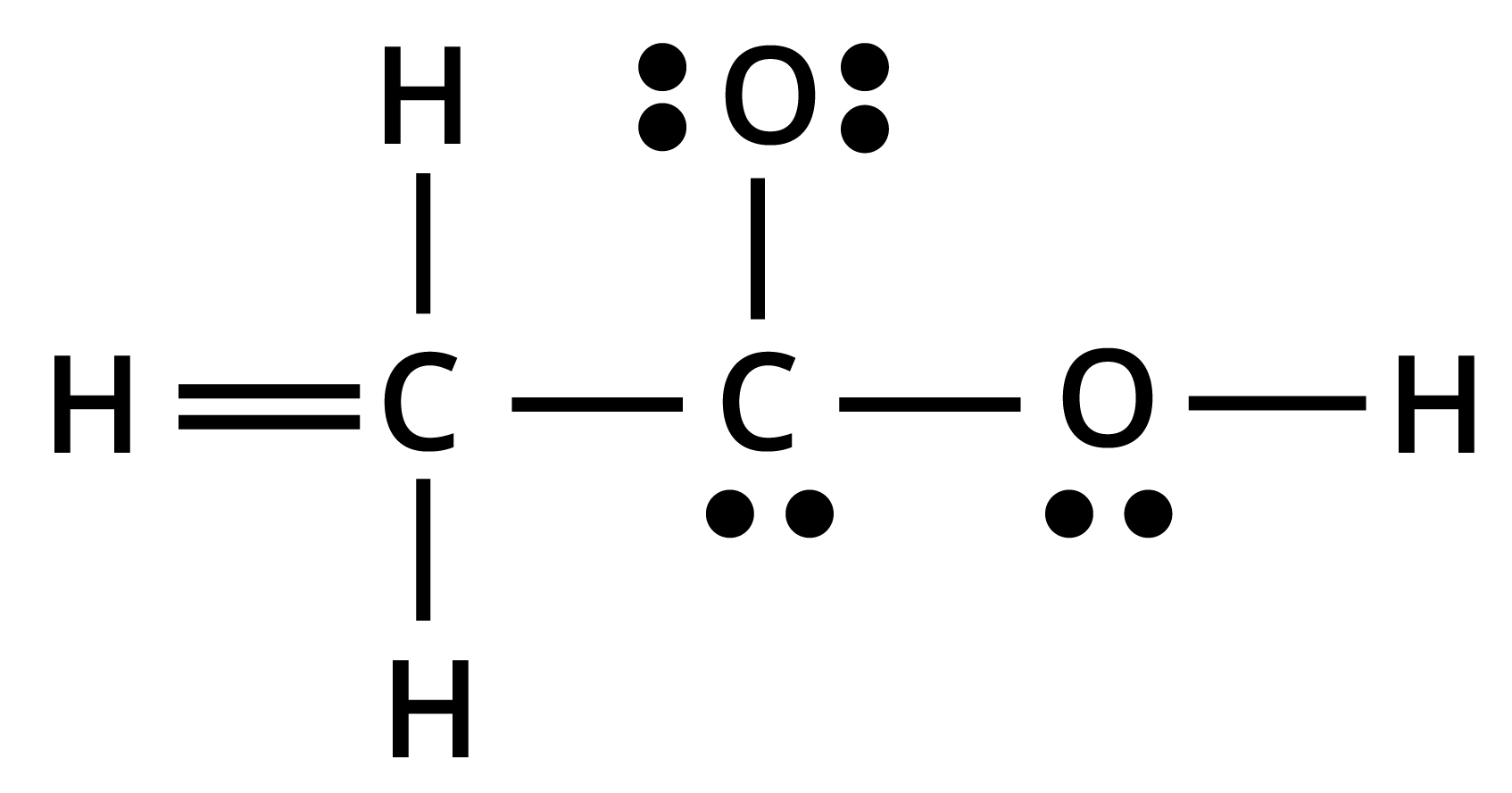
20. $C{H_3}COOH$ की नीचे दी गई ढाँचा-संरचना सही है, परन्तु कुछ आबन्ध त्रुटिपूर्ण दर्शाए गए हैं। ऐसीटिक अम्ल की सही लूइस-संरचना लिखिए-
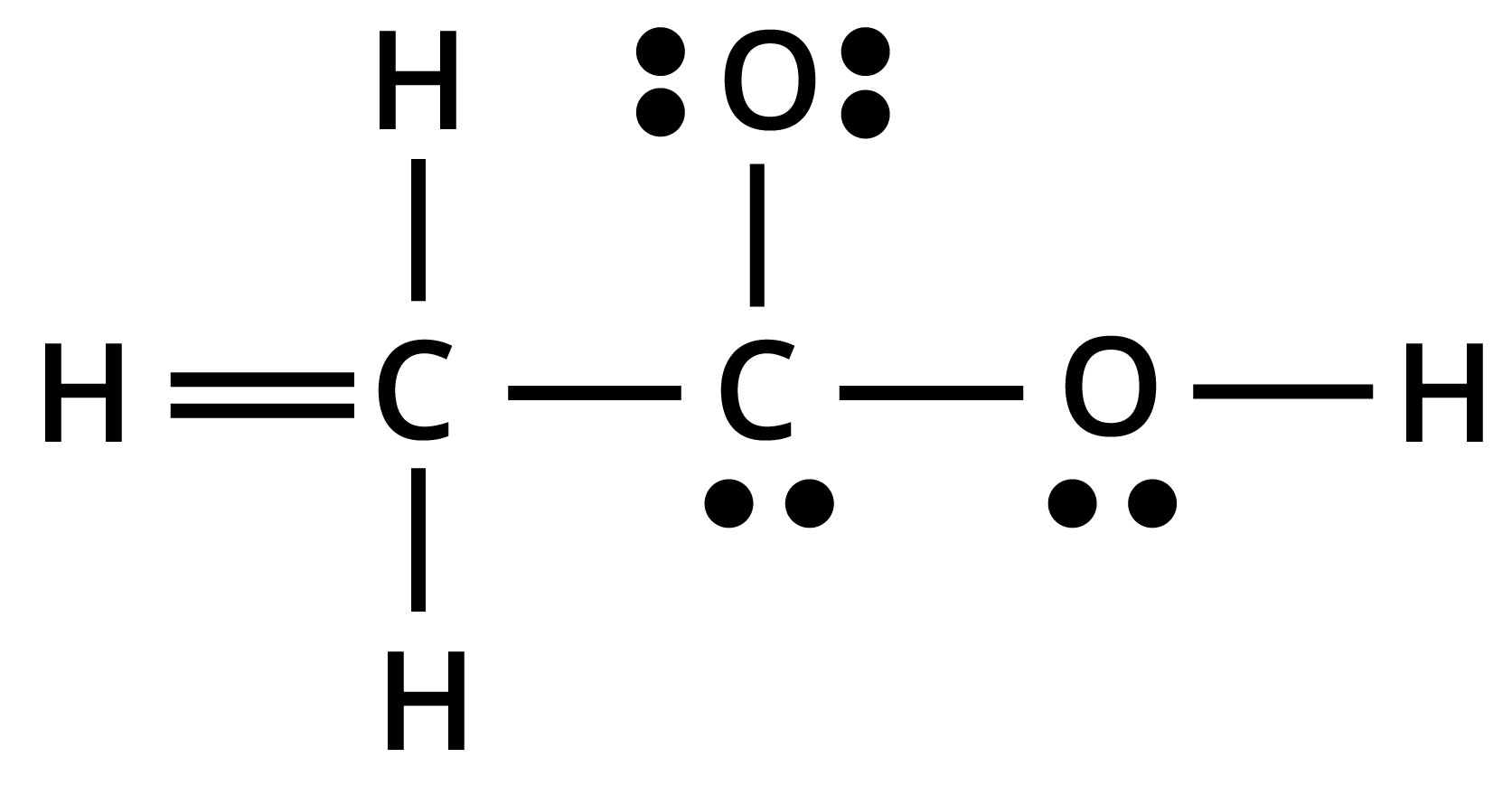
उत्तर:
सही लुइस संरचना निम्न है-
21. चतुष्फलकीय ज्यामिति के अलावा $C{H_4}$ अणु की एक और सम्भव ज्यामिति वर्ग-समतली है जिसमें हाइड्रोजन के चार परमाणु एक वर्ग के चार कोनों पर होते हैं। व्याख्या कीजिए कि $C{H_4}$ का अणु वर्ग-समतली नहीं होता है।
उत्तर:
वर्ग-समतली ज्यामिति के लिए, संकरण आवश्यक है। कार्बन परमाणु को उत्तेजित अवस्था में विन्यास \[1{s^2}2{s^2}2{p^1}x{\text{ }}2{p^1}y,{\text{ }}2{p^1}z\] है। इसके पास \[4 - \]कक्षक नहीं है। अत: यह \[ds{p^2}\] संकरण में भाग नहीं ले सकता। इस कारण $C{H_4}$ की वर्ग–समतली आकृति सम्भव नहीं है। $C{H_4}$ में, कार्बन परमाणु \[s{p^3}\] संकरित अवस्था में होता है जो $C{H_4}$ के अणु को आकृति में चतुष्फलकीय (tetrahedral) बनाता है।
22. यद्यपि $Be - H$ आबन्ध ध्रुवीय है, तथापि \[Be{H_2}\], अणु का द्विध्रुव आघूर्ण शून्य है। स्पष्ट कीजिए।
उत्तर:
\[sp\] संकरण के कारण \[Be{H_2}\] अणु की ज्यामिति रेखीय होती है। इस कारण इसमें उपस्थित दोनों $Be - H$ आबन्धों के आबन्ध आघूर्ण (bond moments) एक-दूसरे के विपरीत दिशा में कार्य करते हैं। परिणाम में समान होने के कारण तथा विपरीत दिशा में कार्य करने के कारण ये एक-दूसरे का निराकरण कर देते हैं। फलस्वरूप \[Be{H_2}\] का द्विध्रुव आघूर्ण शून्य प्राप्त होता है।
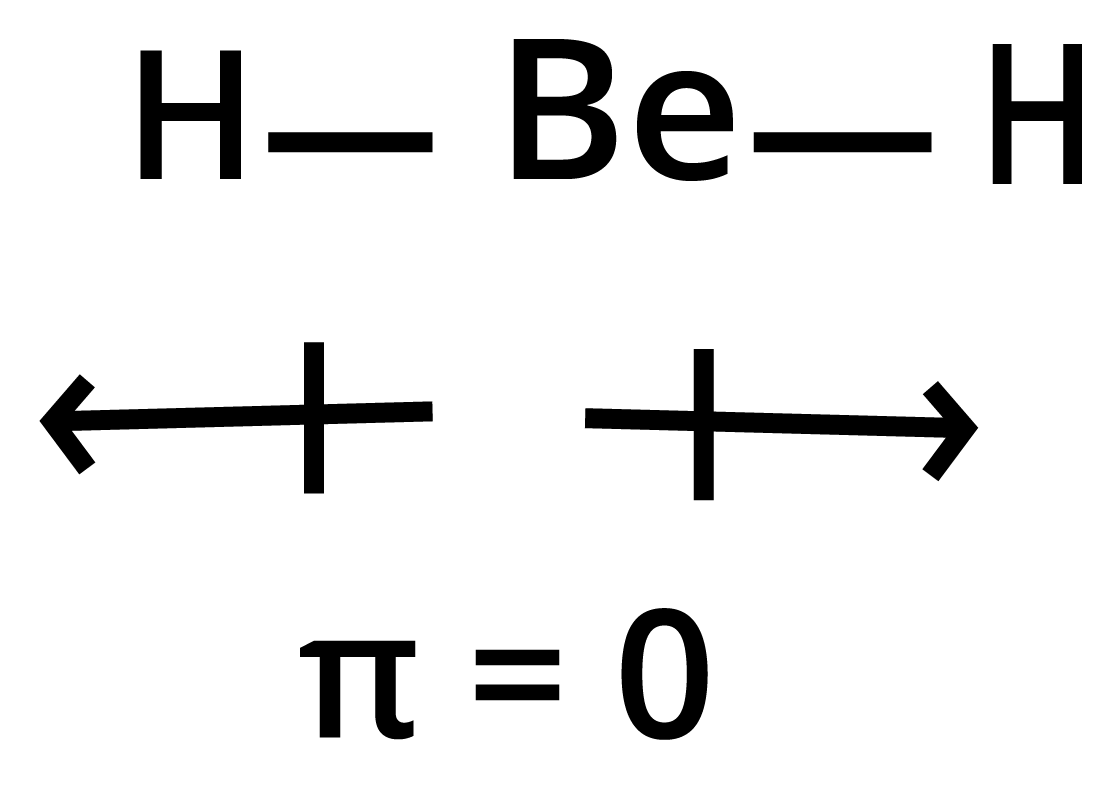
23. $N{H_3}$ तथा $N{F_3}$ में किस अणु का द्विध्रुव आघूर्ण अधिक है और क्यों?
उत्तर:
$N{H_3}$ तथा $N{F_3}$, दोनों अणुओं की पिरामिडी आकृति होती है तथा दोनों $N{H_3}$(\[3.0 - 2.1{\text{ }} = {\text{ }}0.9\]) तथा $N{F_3}$(\[4.0 - 3.0{\text{ }} = {\text{ }}1.0\]) अणुओं में विद्युत-ऋणात्मकता अन्तर भी लगभग समान होता है, परन्तु का द्विध्रुव आघूर्ण (\[1.46{\text{ }}D\]), $N{F_3}$(\[0.24{\text{ }}D\]) की तुलना में अधिक होता है।
इसकी व्याख्या द्विध्रुव आघूर्णो की दिशा में अन्तर के आधार पर की जा सकती है। $N{H_3}$ में नाइट्रोजन परमाणु पर उपस्थित एकाकी इलेक्ट्रॉन-युग्म का कक्षक द्विध्रुव आघूर्ण तीन $N - F$ आबन्धों के द्विध्रुव आघूर्गों के परिणामी द्विध्रुव आघूर्ण की विपरीत दिशा में होता है। कक्षक द्विध्रुव आघूर्ण एकाकी इलेक्ट्रॉन-युग्मं के कारण $N - F$ आबन्ध-आघूर्गों के परिणामी द्विध्रुव आधूर्ण के प्रभाव को कम करता है। इसके फलस्वरूप $N{F_3}$ के अणु का द्विध्रुव आघूर्ण कम होता है।
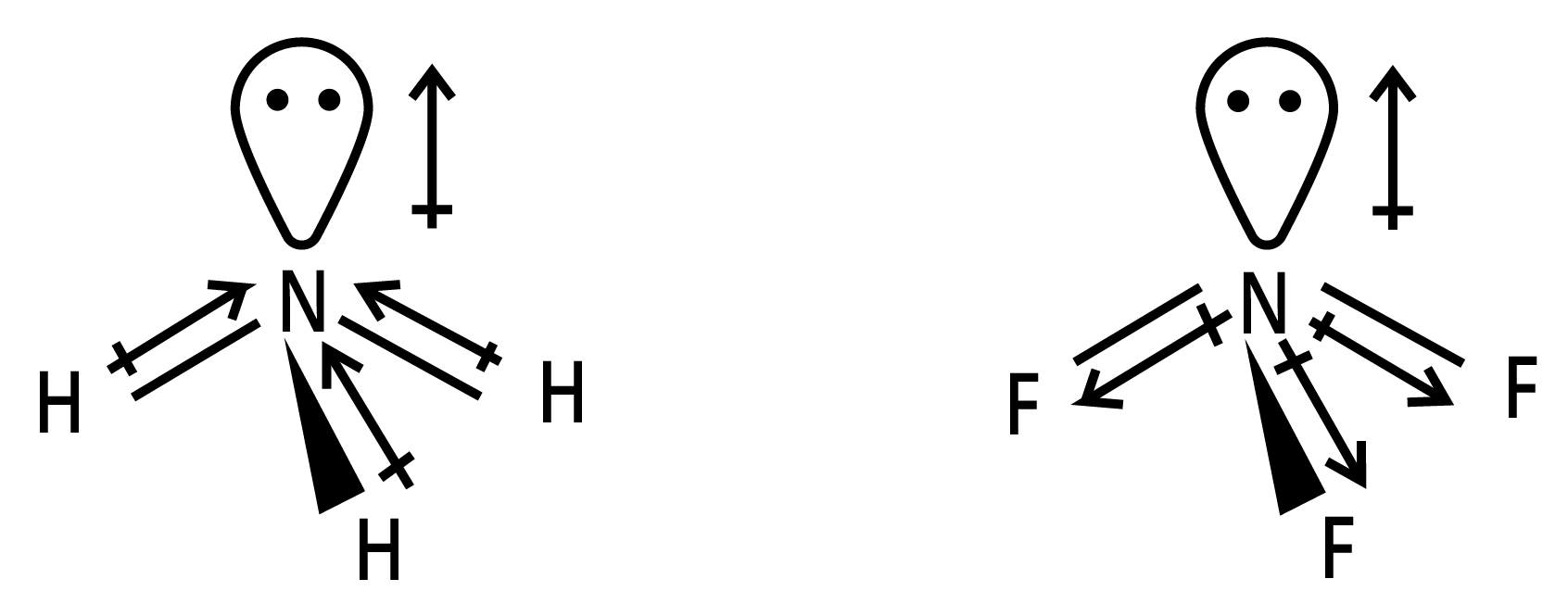
24. परमाणु कक्षकों के संकरण से आप क्या समझते हैं। $sp,s{p^2},s{p^3}$ संकर कक्षकों की आकृति का वर्णन कीजिए।
उत्तर: \[C{H_4},{\text{ }}N{H_5},{\text{ }}{H_2}O\]
संकरण (Hybridisation) जैसे बहुपरमाणुक अणुओं की विशिष्ट ज्यामितीय आकृतियों को स्पष्ट करने के लिए पॉलिंग ने परमाणु कक्षकों के सिद्धान्त को प्रतिपादित किया। पॉलिंग के अनुसार परमाणु कक्षक संयोजित होकर समतुल्य कक्षकों का समूह बनाते हैं। इन कक्षकों को संकर कक्षक कहते हैं। आबन्ध विरचन में परमाणु शुद्ध कक्षकों के स्थान पर संकरित कक्षकों का प्रयोग करते हैं। इस परिघटना को हम संकरण कहते हैं। इसे निम्नवत् परिभाषित किया जा सकता है
“लगभग समान ऊर्जा वाले कक्षकों के आपस में मिलकर ऊर्जा के पुनर्वितरण द्वारा समान ऊर्जा तथा आकार वाले कक्षकों को बनाने की प्रक्रिया को संकरण कहते हैं।”
उदाहरणार्थ-कार्बन का एक कक्षक तथा तीन \[2p\] कक्षक संकरण द्वारा चार नए \[{\mathbf{s}}{{\mathbf{p}}^{\mathbf{3}}}\] संकर कक्षक बनाते हैं।
\[{\mathbf{sp}},{\text{ }}{\mathbf{s}}{{\mathbf{p}}^{\mathbf{2}}}\] तथा \[{\mathbf{s}}{{\mathbf{p}}^{\mathbf{3}}}\] संकर कक्षकों की आकृति (Shapes of $sp,s{p^2},s{p^3}$ hybrid orbitals)
\[{\mathbf{sp}},{\text{ }}{\mathbf{s}}{{\mathbf{p}}^{\mathbf{2}}}\] तथा \[{\mathbf{s}}{{\mathbf{p}}^{\mathbf{3}}}\] संकर कक्षकों की आकृति का वर्णन निम्नलिखित है–
(i) \[sp\] संकर कक्षक ( \[sp\]-hybridised orbitals)- \[sp\] संकरण में परमाणु की संयोजकता कोश के -उपकोश का एक कक्षक तथा p-उपकोश का एक कक्षक मिलकर समान आकृति एवं तुल्य ऊर्जा के \[sp\] संकरित कक्षक बनाते हैं। ये कक्षक आकृति में \[180^\circ \] के कोण पर अभिविन्यसित होते हैं।
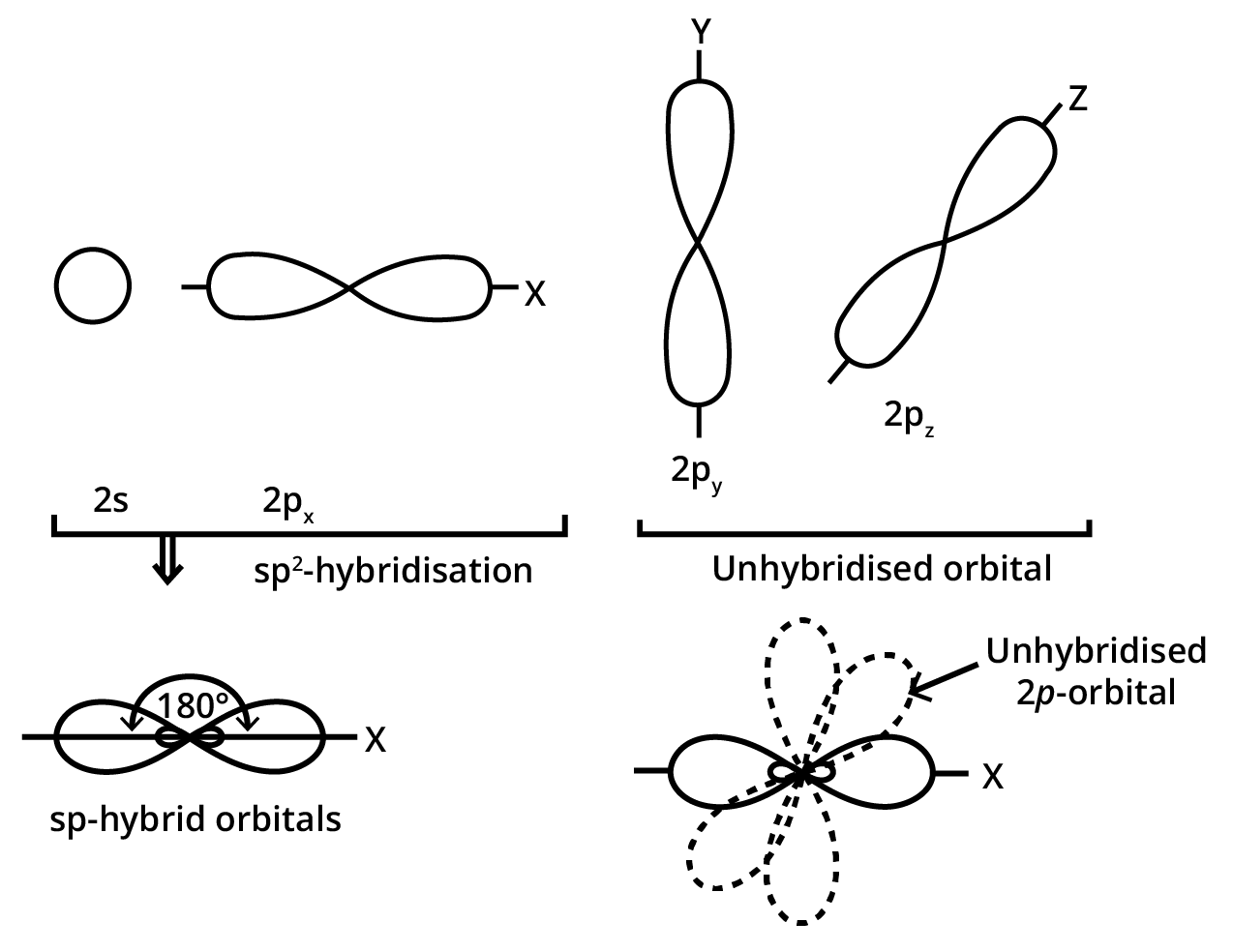
(ii) \[{\mathbf{s}}{{\mathbf{p}}^{\mathbf{2}}}\] संकरे कक्षक (\[{\mathbf{s}}{{\mathbf{p}}^{\mathbf{2}}}\] -hybridised orbitals)- \[{\mathbf{s}}{{\mathbf{p}}^{\mathbf{2}}}\]– संकरण में परमाणु की संयोजकता कोश के \[5 - \] उपकोश का एक कक्षक तथा \[p - \] उपकोश के दो कक्षक संयोजित होकर समान आकृति एवं तुल्य ऊर्जा के \[{\mathbf{s}}{{\mathbf{p}}^{\mathbf{2}}}\] संकर कक्षक बनाते हैं। ये \[{\mathbf{s}}{{\mathbf{p}}^{\mathbf{2}}}\] संकर कक्षक एक तल में स्थित होते हैं तथा एक समबाहु त्रिभुज के कोनों पर एवं \[120^\circ \] कोण पर निर्देशित रहते हैं।
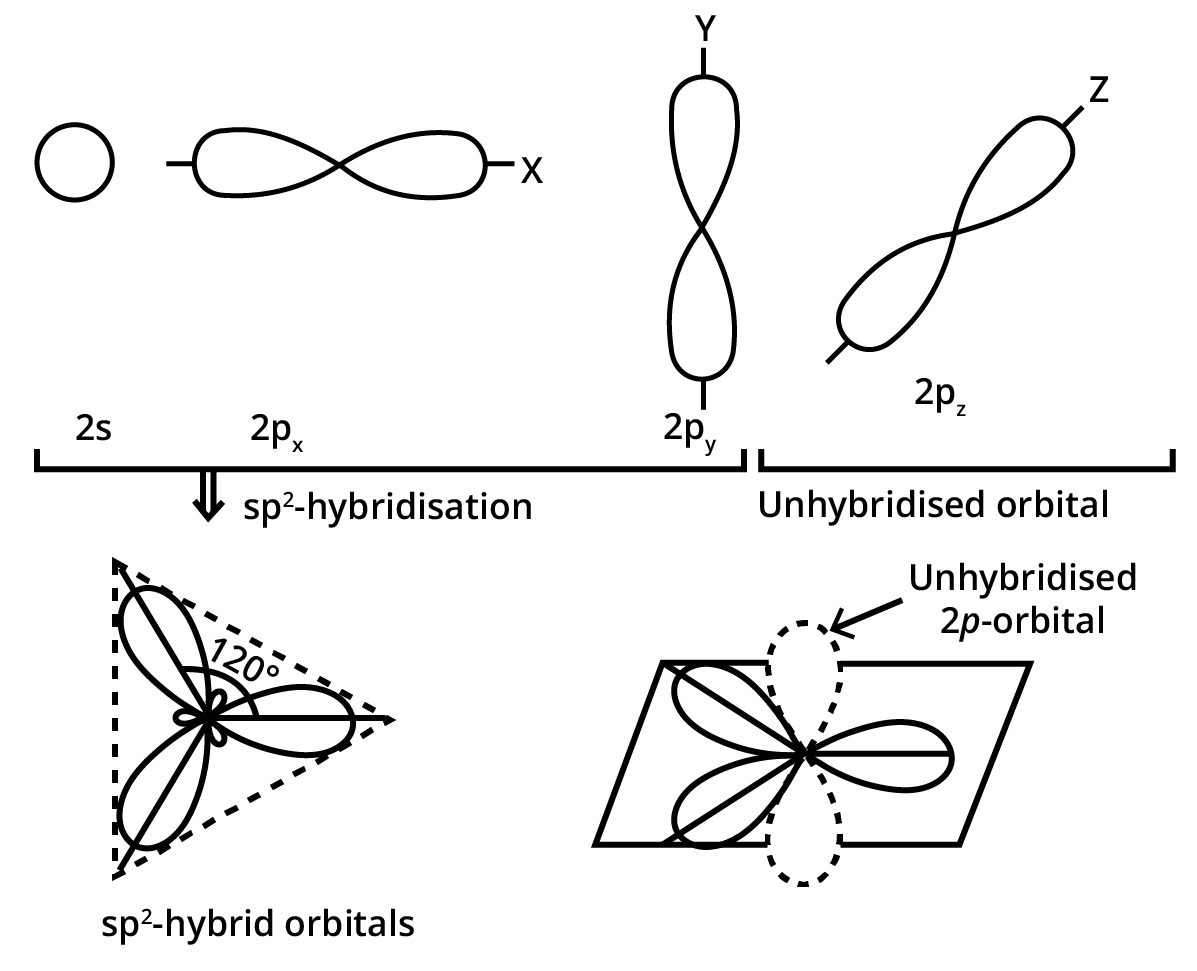
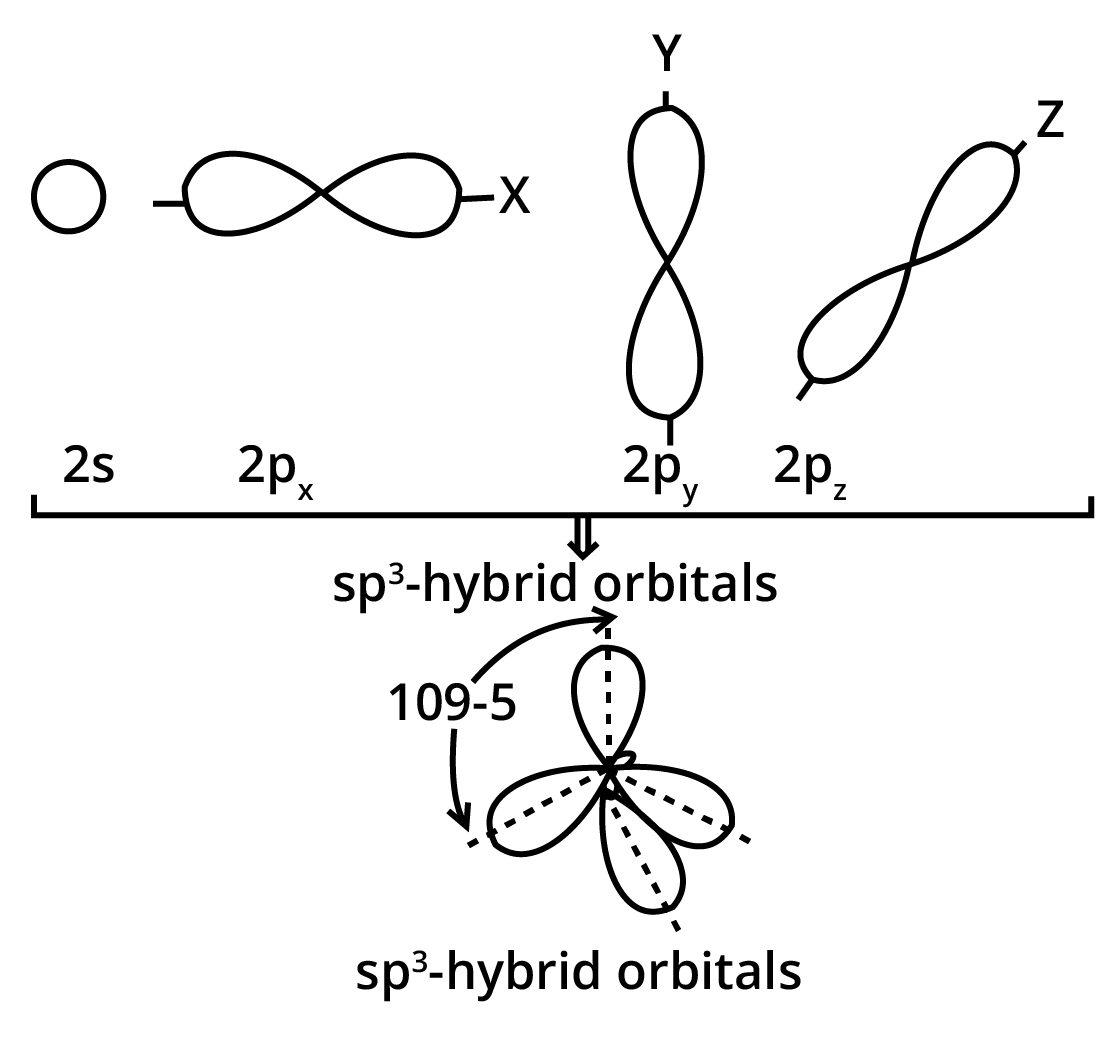
(iii) \[{\mathbf{s}}{{\mathbf{p}}^{\mathbf{3}}}\]संकर कक्षक ( \[{\mathbf{s}}{{\mathbf{p}}^{\mathbf{3}}}\]-hybridised orbitals)- \[{\mathbf{s}}{{\mathbf{p}}^{\mathbf{3}}}\] संकरण में परमाणु की संयोजकता कोश के -उपकोश, का एक कक्षक तथा \[p - \] उपकोश के तीन कक्षक संयोजित होकर समान आकृति एवं तुल्य ऊर्जा के चार \[{\mathbf{s}}{{\mathbf{p}}^{\mathbf{3}}}\] संकर कक्षक बनाते हैं। ये चारों \[{\mathbf{s}}{{\mathbf{p}}^{\mathbf{3}}}\] संकर कक्षक एक चतुष्फलक के चारों कोनों पर निर्देशित रहते हैं।
25. निम्नलिखित अभिक्रिया में \[Al\] परमाणु की संकरण अवस्था में परिवर्तन (यदि होता है तो) को समझाइए- \[AlC{l_3} + {\text{ }}C{l^--} \Rightarrow {\text{ }}AlC{l^{--4}}\]
उत्तर:
$AlC{l_3}$, का निर्माण, केन्द्रीय परमाणु के \[{\mathbf{s}}{{\mathbf{p}}^{\mathbf{2}}}\] संकरण के द्वारा होता है। (\[Al:{\text{ }}1{s^2}2{s^2}2{p^6}3{s^1}3{p^1}x{\text{ }}3{p^1}--){\text{ }}AlC{l^--}4\] निर्माण \[{\mathbf{s}}{{\mathbf{p}}^{\mathbf{3}}}\] संकरण के द्वारा होता है (क्योंकि $AlC{l^{ - 4}}$ में, \[Al\] की रिक्त \[3pz\], कक्षक भी संकरण में सम्मलित है) इसलिए दी गई अभिक्रिया में \[Al\] की संकरण अवस्था \[{\mathbf{s}}{{\mathbf{p}}^{\mathbf{2}}}\] से \[{\mathbf{s}}{{\mathbf{p}}^{\mathbf{3}}}\] में परिवर्तित होती है।
26. क्या निम्नलिखित अभिक्रिया के फलस्वरूप \[B\] तथा \[N\] परमाणुओं की संकरण-अवस्था में परिवर्तन होता है?
$B{F_3} + N{H_2} \to {F_3}B \cdot N{H_3}$
उत्तर:
$N{H_3}$ में $N$ की संकरण अवस्था अर्थात् \[{\mathbf{s}}{{\mathbf{p}}^{\mathbf{3}}}\] अपरिवर्तित रहती है।
$B{F_3}$ में बोरोन परमाणु \[{\mathbf{s}}{{\mathbf{p}}^{\mathbf{2}}}\] संकरित है, जबकि ${F_3}BN{H_3}$ में यह \[{\mathbf{s}}{{\mathbf{p}}^{\mathbf{3}}}\] संकरित है। इसलिए, दी गई अभिक्रिया में $B$ की संकरण अवस्था \[{\mathbf{s}}{{\mathbf{p}}^{\mathbf{2}}}\] से \[{\mathbf{s}}{{\mathbf{p}}^{\mathbf{2}}}\] में परिवर्तित होती है।
27. ${C_2}{H_4}$ तथा ${C_2}{H_2}$ अणुओं में कार्बन परमाणुओं के बीच क्रमशः द्वि-आबन्ध तथा त्रि-आबन्ध के निर्माण को चित्र द्वारा स्पष्ट कीजिए।
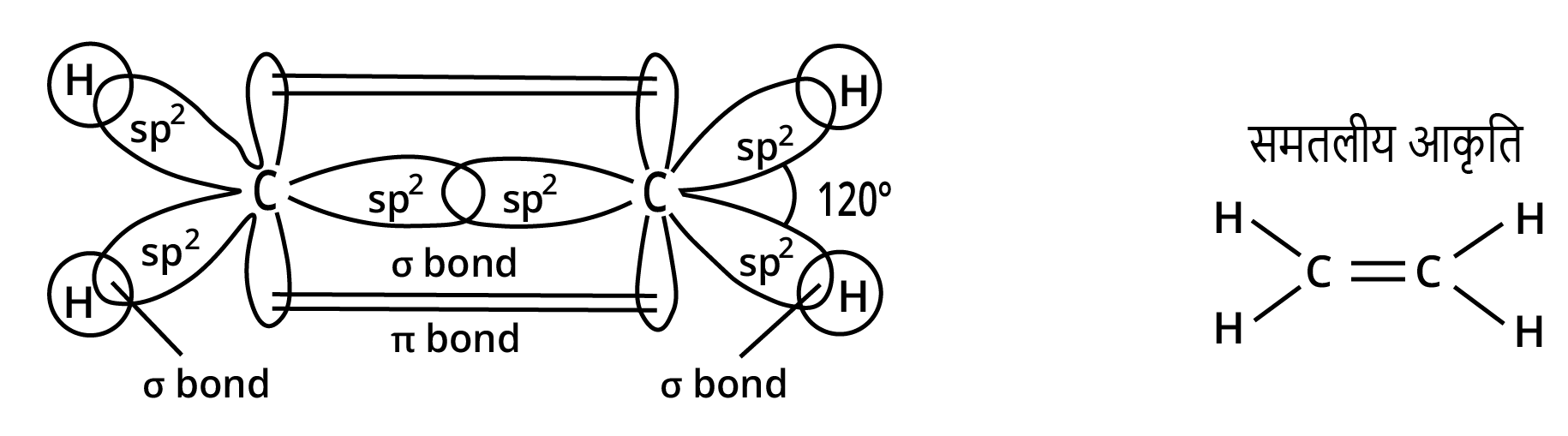
उत्तर:
(i) ${C_2}{H_4}$
उत्तर:
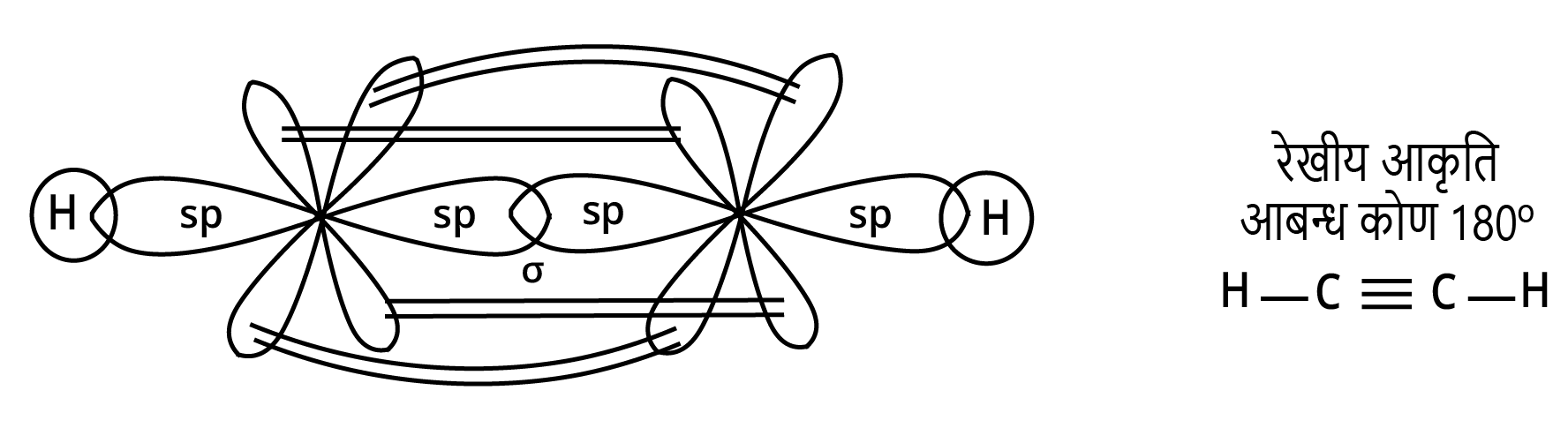
(ii) ${C_2}{H_2}$
उत्तर:
28. निम्नलिखित अणुओं में सिग्मा (\[{\mathbf{\sigma }}\]) तथा पाई (\[{\mathbf{\pi }}\]) आबन्धों की कुल संख्या कितनी है?
(क) ${C_2}{H_2}$
उत्तर:
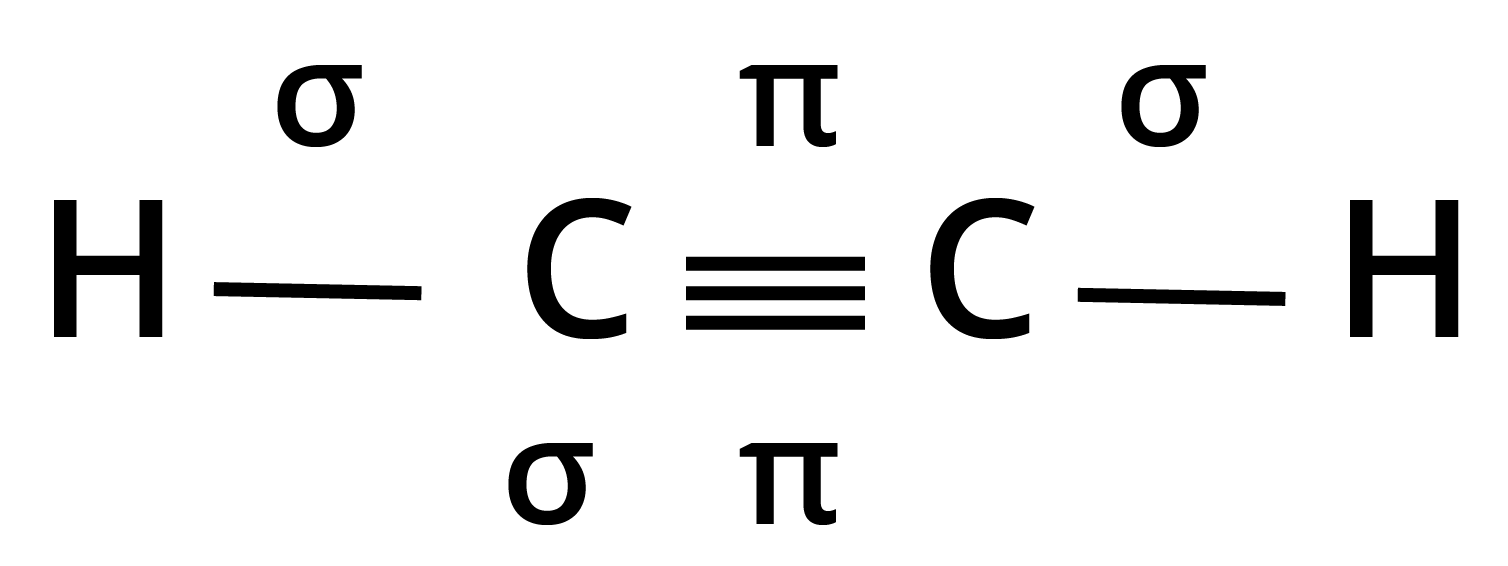
कुल आबन्ध : $3\sigma $ तथा $2\pi $
(ख) ${C_2}{H_4}$
उत्तर:
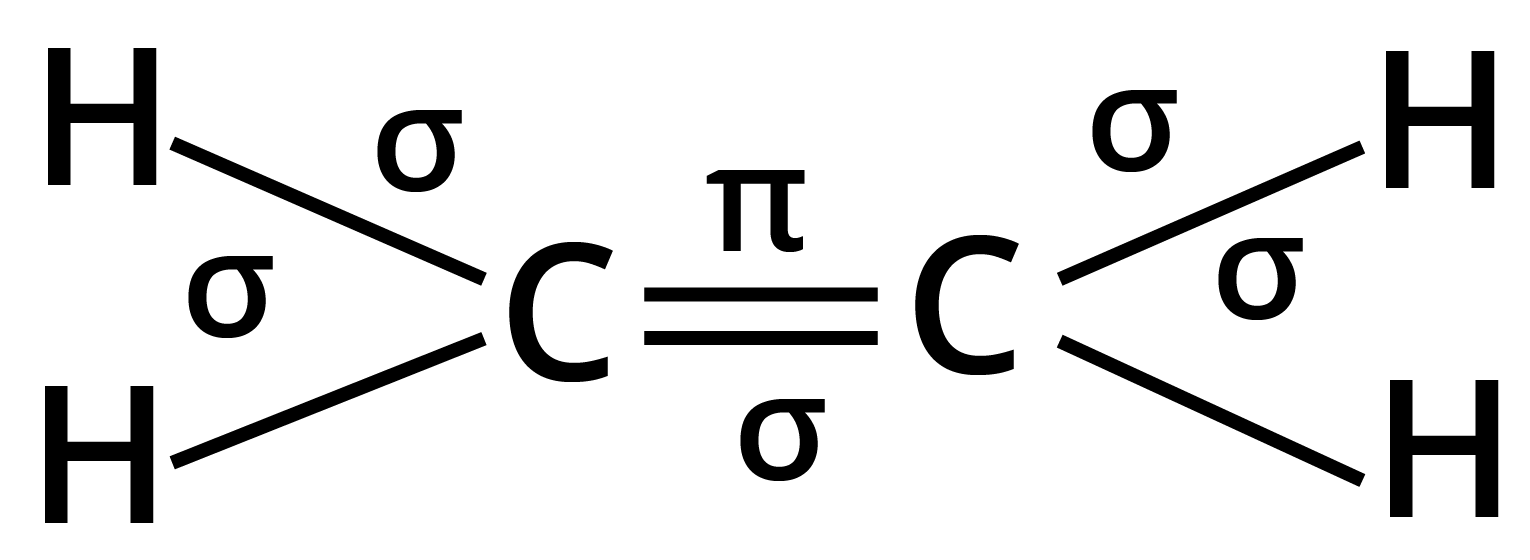
कुल आबन्ध : $5\sigma $ तथा $1\pi $
29. \[X - \]अक्ष को अन्तर्नाभिकीय अक्ष मानते हुए बताइए कि निम्नलिखित में कौन-से कक्षक सिग्मा (\[{\mathbf{\sigma }}\]) आबन्ध नहीं बनाएँगे और क्यों?
(क) \[1s\] तथा \[1s\] ,
(ख) \[1s\] तथा \[2px\] ;
(ग) \[2py\] तथा \[2py\]
(घ) \[1s\] तथा \[2s\]
उत्तर:
(क), (ख) तथा (घ) सिग्मा (\[{\mathbf{\sigma }}\]) आबन्ध बनायेंगे क्योंकि कक्षक गोलीय सममित (spherically symmetric) हैं।
(घ) अर्थात् \[2py\], तथा \[2py\], सिग्मा आबन्ध नहीं बना सकते, क्योंकि ये ऑर्बिटल \[y - \] अक्ष के अनुतटीय होने के कारण अक्षीय अतिव्यापन नहीं कर सकते और इस प्रकार \[o - \]आबन्ध का निर्माण नहीं कर सकते। ये केवल पार्श्ववत अतिव्यापन कर \[7\] आबन्धु बना सकते हैं, यदि -अक्ष अन्तरानाभिकीय अक्ष हैं।
30. निम्नलिखित अणुओं में कार्बन परमाणु कौन-से संकर कक्षक प्रयुक्त करते हैं?
(क) \[C{H_3}--C{H_3}\]
उत्तर:
![\[C{H_3}--C{H_3}\]](https://elitestealsonly.com/seo/content-images/16f4f5dc-e8f5-4af8-a720-6e3b5b12b582.png)
दोनों ${{\text{C}}_1}$ तथा ${{\text{C}}_2},s{p^3}$ संकरित कक्षकों को प्रयक्त करते हैं।
(ख) \[C{H_3}---CH = C{H_2}\]
उत्तर:
![\[C{H_3}---CH = C{H_2}\]](https://elitestealsonly.com/seo/content-images/9e23c689-c118-4527-b46a-ce231cc1cf0b.png)
${{\text{C}}_1}$ कार्बन $s{p^3}$ तथा ${{\text{C}}_2}$ एवं ${{\text{C}}_3}$ कार्बन $s{p^2}$ संकरित कक्षकों को प्रयुक्त करते हैं।
(ग) \[C{H_3}---C{H_2}---OH\]
उत्तर:
![\[C{H_3}---C{H_2}---OH\]](https://elitestealsonly.com/seo/content-images/b5e60e47-864a-455a-b190-81d950ad3c5d.png)
दोनों ${{\text{C}}_1}$ तथा ${{\text{C}}_2},s{p^3}$ संकरित कक्षकों को प्रयक्त करते हैं।
(घ) \[C{H_3}CHO\]
उत्तर:
![\[C{H_3}CHO\]](https://elitestealsonly.com/seo/content-images/6a9c27e4-34b1-4a3d-82db-197247f8b29e.png)
दोनों ${{\text{C}}_1}$ तथा ${{\text{C}}_2},s{p^2}$ संकरित कक्षकों को प्रयक्त करते हैं।
(ङ) \[C{H_3}COOH\]
उत्तर:
![\[C{H_3}COOH\]](https://elitestealsonly.com/seo/content-images/558b5c6a-b332-49d1-8d08-bc1b6ff5bd93.png)
दोनों ${{\text{C}}_1}$ तथा ${{\text{C}}_2},s{p^2}$ संकरित कक्षकों को प्रयक्त करते हैं।
31. इलेक्ट्रॉनों के आबन्धी युग्म तथा एकाकी युग्म से आप क्या समझते हैं? प्रत्येक को एक उदाहरण द्वारा स्पष्ट कीजिए।
उत्तर:
दो आबन्धी सहसंयोजी परमाणुओं के बीच उपस्थित इलेक्ट्रॉन्स के सहभागी युग्म, आबन्धी युग्म कहलाते हैं। वे इलेक्ट्रॉन्स युग्म जो परमाणु पर उपस्थित होते हैं परन्तु सहसंयोजी आबन्ध निर्माण में भाग नहीं लेते हैं, एकाकी युग्म कहलाते हैं। उदाहरणार्थ-

32. सिग्मा तथा पाई आबन्ध में अन्तर स्पष्ट कीजिए।
उत्तर:
सिग्मा व पाई आबन्धों में अन्तर (Differences between Sigma and pi Bonds)
$\sigma $ -आबन्ध | ${\pi ^ - }$ |
यह कक्षकों के अक्षों पर परस्पर अतिव्यापन द्वारा बनता है। | यह दो $p$ या $d$ या $p$ व $d$ असंकरित कक्षकों के पाश्व अतिव्यापन द्वारा बनता है। |
यह $s - s,s - p,p - p$ या संकरित-असकरित आदि कक्षकों के अतिव्यापन पर बनता है | यह $p$ या $d$ या $p$ व $d$ कक्षकों के अतिव्यापन से बनता है। |
इसमें मुक्त घूर्णन सम्भव है। | इसमें मुक्त घूर्णन सम्भव नहीं है। |
यह अधिक स्थायी व कम क्रियाशील होता है। | यह अस्थायी व अधिक क्रियाशील होता है। |
यह अणु की आकृति निर्धारित करता है। | इसका अणुओं की आकृति पर कोई प्रभाव नहीं होता, बल्कि यह आबन्ध कोण को प्रभावित करता है। |
33. संयोजकता आबन्ध सिद्धान्त के आधार पर ${H_2}$ अणु के विरचन की व्याख्या कीजिए।
उत्तर:
संयोजक्ता आबन्ध सिद्धान्त को सर्वप्रथम हाइटलर तथा लंडन (Heitler and London) ने सन् \[1927\] में प्रस्तुत किया था जिसका विकास पॉलिंग (Pauling) तथा अन्य वैज्ञानिकों ने बाद में किया। इस सिद्धान्त का विवेचन परमाणु कक्षकों, तत्वों के इलेक्ट्रॉनिक विन्यासों, परमाणु कक्षकों के अतिव्यापन और संकरण तथा विचरण (variation) एवं अध्यारोपण (superposition) के सिद्धान्तों के ज्ञान पर आधारित है। इस सिद्धान्त के आधार पर ${H_2}$ अणु के विरचन की व्याख्या निम्नवत् की जा सकती है–
\[H\left( g \right) + H\left( g \right){\text{ }} \to {\text{ }}{H_2}\left( g \right) + 433{\text{ }}kJ{\text{ }}mo{l^{ - 1}}\]
यह प्रदर्शित करता है कि हाइड्रोजन अंणु की ऊर्जा हाइड्रोजन परमाणुओं की तुलना में कम है। सामान्यत: जब कभी परमाणु संयोजित होकर अणु बनाते हैं, तब ऊर्जा में अवश्य ही कमी आती है जो स्थायित्व को बढ़ा देती है।
मानो हाइड्रोजन के दो परमाणु $A$ व $B$, जिनके नाभिक क्रमशः \[{N_A}\] व \[{N_B}\] हैं तथा उनमें उपस्थित इलेक्ट्रॉनों को \[{e_A}\] और \[{e_B}\] द्वारा दर्शाया गया है, एक-दूसरे की ओर बढ़ते हैं। जब ये दो परमाणु एक-दूसरे से अत्यधिक दूरी पर होते हैं, तब उनके बीच कोई अन्योन्यक्रिया नहीं होती। ज्यों-ज्यों दोनों परमाणु एक-दूसरे के समीप आते-जाते हैं, त्यों-त्यों उनके बीच आकर्षण तथा प्रतिकर्षण बल उत्पन्न होते जाते हैं।
आकर्षण बल निम्नलिखित में उत्पन्न होते हैं-
1. एक परमाणु के नाभिक तथा उसके इलेक्ट्रॉनों के बीच
N\[_{A}\] - - e\[_{A}\]
N\[_{B}\] - - e\[_{B}\]
2. एक परमाणु के नाभिक तथा दूसरे परमाणु के इलेक्ट्रॉनों के बीच
N\[_{A}\] - - e\[_{B}\]
N\[_{B}\] - - e\[_{A}\]
इसी प्रकार प्रतिकर्षण बल निम्नलिखित में उत्पन्न होते हैं-
1. दो परमाणुओं के इलेक्ट्रॉनों के बीच e\[_{A}\]- - e\[_{B}\] तथा
2. दो परमाणुओं के नाभिकों के बीच N\[_{A}\] - - N\[_{B}\]
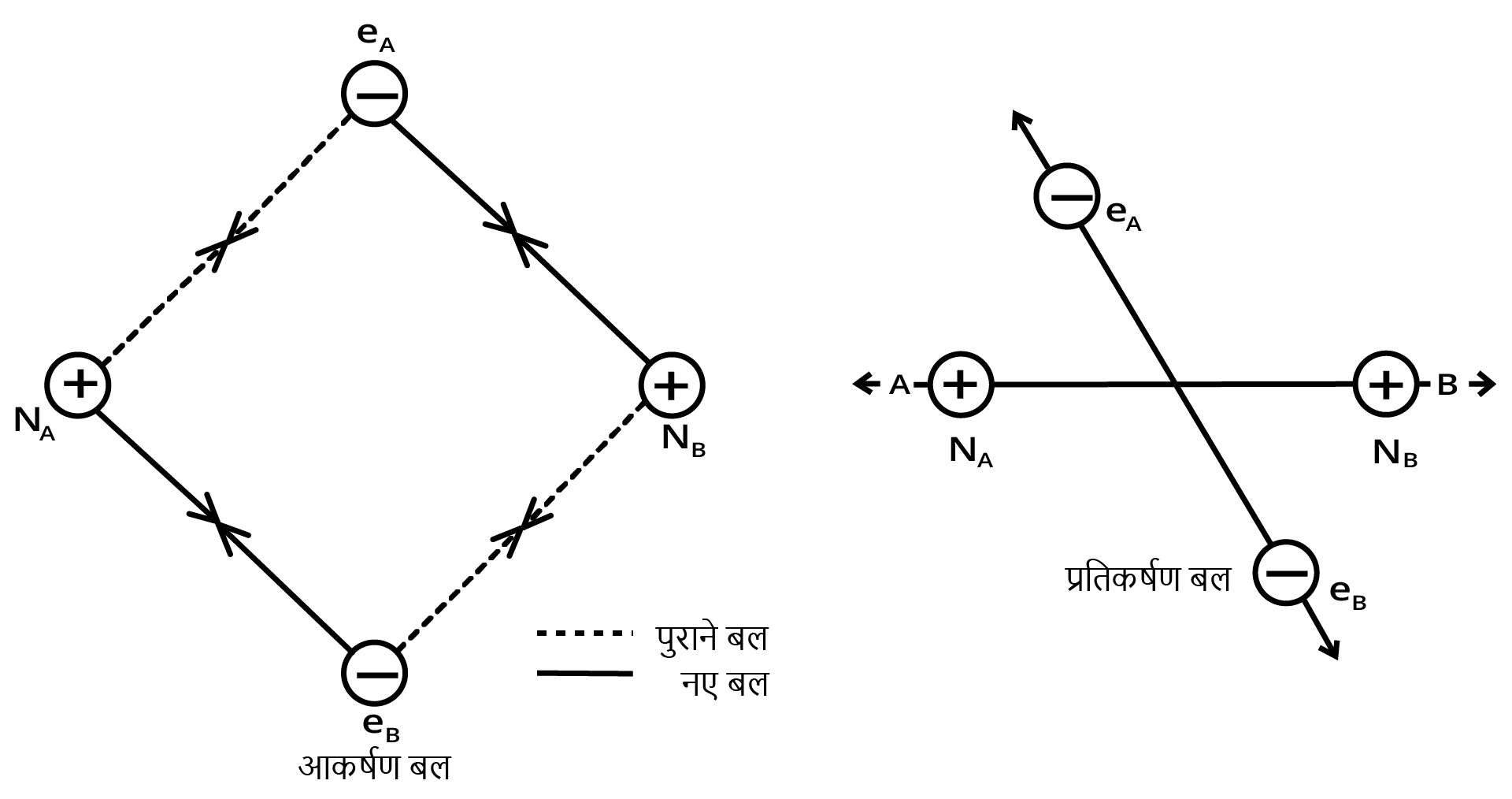
आकर्षण बल दोनों परमाणुओं को एक-दूसरे के पास लाते हैं, जबकि प्रतिकर्षण बल उन्हें दूर करने का प्रयास करते हैं (चित्र)।
प्रायोगिक तौर पर यह पाया गया है कि नए आकर्षण बलों का मान नए प्रतिकर्षण बलों के मान से अधिक होता है। इसके परिणामस्वरूप दोनों परमाणु एक-दूसरे के समीप आते हैं तथा उनकी स्थितिज ऊर्जा कम हो जाती है। अन्ततः ऐसी स्थिति आ जाती है कि नेट आकर्षण बल, प्रतिकर्षण बल के बराबर हो जाता है और निकाय की ऊर्जा न्यून स्तर पर पहुँच जाती है। इस अवस्था में हाइड्रोजन के. परमाणु ‘आबन्धित कहलाते हैं और एक स्थायी अणु बनाते हैं जिसकी आबन्ध-लम्बाई \[74{\text{ }}pm\] होती है।
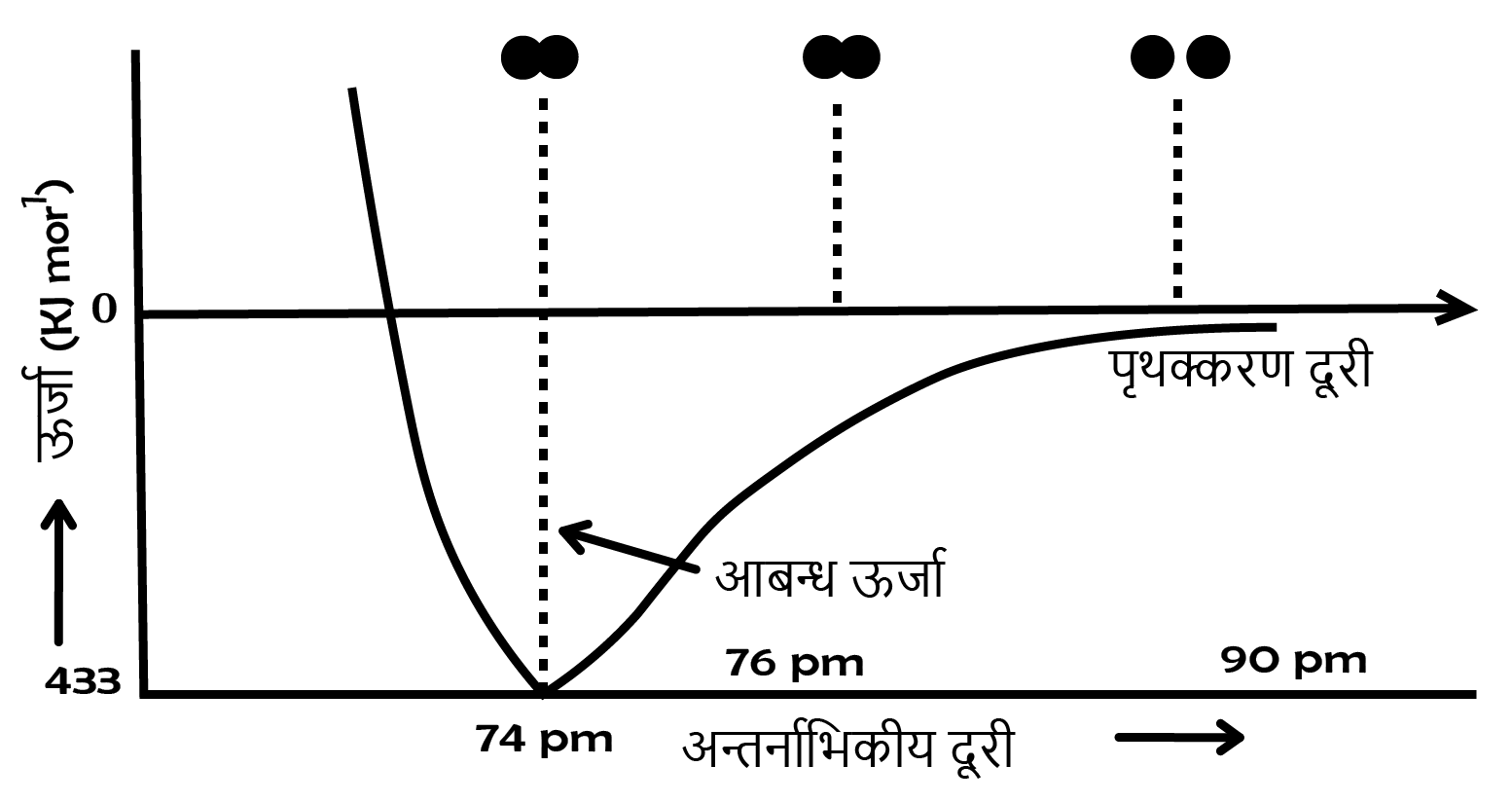
चूंकि हाइड्रोजन के दो परमाणुओं के बीच आबन्ध बनने पर ऊर्जा मुक्त होती है, इसलिए हाइड्रोजन अणु दो पृथक् परमाणुओं की अपेक्षा अधिक स्थायी होता है। इस प्रकार मुक्त ऊर्जा ‘आबन्ध एन्थैल्पी’ कहलाती है।
यह चित्र- में दिए गए आरेख के संगत होती है। विलोमत: ${H_2}$ के एक मोल अणुओं के वियोजन के लिए \[433{\text{ }}kJ\] ऊर्जा की आवश्यकता होती है, इसे आबन्ध वियोजन ऊर्जा कहा जाता है।
\[{H_2}\left( g \right){\text{ }}433{\text{ }}kJ{\text{ }}mo{l^{ - 1}} \to {\text{ }}H\left( g \right) + H\left( g \right)\]
34. परमाणु कक्षकों के रैखिक संयोग से आण्विक कक्षक बनने के लिए आवश्यक शर्तों को लिखिए।
उत्तर:
परमाणु कक्षकों के रैखिक संयोग से आण्विक कक्षकों के निर्माण के लिए निम्नलिखित शर्ते अनिवार्य हैं-
1. संयोग करने वाले परमाणु कक्षकों की ऊर्जा समान या लगभग समान होनी चाहिए। इसका तात्पर्य यह है कि एक \[1s\] कक्षक दूसरे \[1s\] कक्षक से संयोग कर सकता है, परन्तु \[2s\] कक्षक से नहीं; क्योकि \[2s\] कक्षक की ऊर्जा कक्षक की ऊर्जा से कहीं अधिक होती है। यह सत्य नहीं है, यदि परमाणु भिन्न प्रकार के हैं।
2. संयोग करने वाले परमाणु कक्षकों की आण्विक अक्ष के परितः समान सममिति होनी चाहिए। परिपाटी के अनुसार, \[z - \]अक्ष को आण्विक अक्ष मानते हैं। यहाँ यह तथ्य महत्त्वपूर्ण है कि समान या लगभग समान ऊर्जा वाले परमाणु कक्षक केवल तभी संयोग करेंगे, जब उनकी सममिति समान है, अन्यथा नहीं। उदाहरणार्थ - \[2p\] परमाणु केक्षक दूसरे परमाणु के \[2p\], कक्षक से संयोग करेगा, परन्तु \[2p\], या \[22\], कक्षकों से नहीं; क्योंकि उनकी सममितियाँ समान नहीं हैं।
3. संयोग करने वाले परमाणु कक्षकों को अधिकतम अतिव्यापन करना चाहिए। जितना अधिक अतिव्यापन होगा, आण्विक कक्षकों के नाभिकों के बीच इलेक्ट्रॉन घनत्व उतना ही अधिक होगा।
35. आण्विक कक्षक सिद्धान्त के आधार पर समझाइए कि $Be$ अणु का अस्तित्व क्यों नहीं होता?
उत्तर:
$Be$ का परमाणु क्रमांक \[4\] है। इसका अर्थ है कि $B{e_2}$ के आण्विक कक्षक में इलेक्ट्रॉन भरे जाएँगे। इसका आण्विक कक्षक विन्यास है-
\[KK{\text{ }}{\left( {\sigma 2s} \right)^2}{\left( {\sigma *2s} \right)^2}\]
आबन्ध कोटि $ = \dfrac{1}{2}(2 - 2) = 0$
चूँकि आबन्ध कोटि शून्य प्राप्त होती है; अत: $B{e_2}$ अणु का अस्तित्व नहीं होता।
36. निम्नलिखित स्पीशीज के आपेक्षिक स्थायित्व की तुलना कीजिए तथा उनके चुम्बकीय गुण इंगित कीजिए-
\[{O_2},{O^ + }_2,{\text{ }}{{\text{O}}^--}_2\] (सुपर ऑक्साइड) तथा $O_2^{2 - }$ (परऑक्साइड)
उत्तर:
दी गई स्पीशीज की आबन्ध कोटि इस प्रकार हैं-
\[\;{O_2}\left( {2.0} \right),{\text{ }}{O^ + }_2\left( {2.5} \right),{\text{ }}{O^--}_2\left( {1.5} \right),{\text{ }}{O^{2 - }}_2\left( {1.0} \right)\]
इनके स्थायित्व का क्रम इस प्रकार होगा-
\[{O^ + }_2 > {\text{ }}{O_2} > {\text{ }}{O^--}_2 > {\text{ }}{O^{2 - }}_2\]
इनके चुम्बकीय गुण निम्नलिखित हैं-
1. \[{O_2}\] अनुचुम्बकीय है।
2. \[O_2^ + \] अनुचुम्बकीय है।
3. \[O_2^ - \] अनुचुम्बकीय है।
4. $O_2^{2 - }$ प्रतिचुम्बकीय है।
37. कक्षकों के निरूपण में उपयुक्त धन (+) तथा ऋण (-) चिह्नों का क्या महत्त्व होता है?
उत्तर:
जब संयोजित होने वाले परमाणु कक्षकों की पालियों (lobes) के चिह्न समान (अर्थात् + तथा + या – तथा:-) होते हैं, तब आबन्धी आण्विक कक्षक बनते हैं। जब संयोजित होने वाले परमाणु कक्षकों की पालियों के चिह्न असमान (अर्थात् + तथा -) होते हैं, तब प्रतिआबन्धी आण्विक कक्षक बनते हैं।
38. $PC{l_5}$ अणु में संकरण का वर्णन कीजिए। इसमें अक्षीय आबन्ध विषुवतीय आबन्धों की अपेक्षा अधिक लम्बे क्यों होते हैं?
उत्तर:
$PC{l_5}$ अणु में \[s{p^3}d - \] संकरण ( hybridisation in PCl5 molecule)-फॉस्फोरस परमाणु (\[Z = 15\]) की तलस्थ अवस्था इलेक्ट्रॉनिक विन्यास को नीचे दर्शाया गया है। फॉस्फोरस की आबन्ध निर्माण परिस्थितियों में कक्षक से एक इलेक्ट्रॉन अयुग्मित होकर रिक्त \[3s2z\] कक्षक में प्रोन्नत हो जाता है। इस प्रकार फॉस्फोरस की उत्तेजित अवस्था के विन्यास को इस प्रकार दर्शाया जा सकता है-
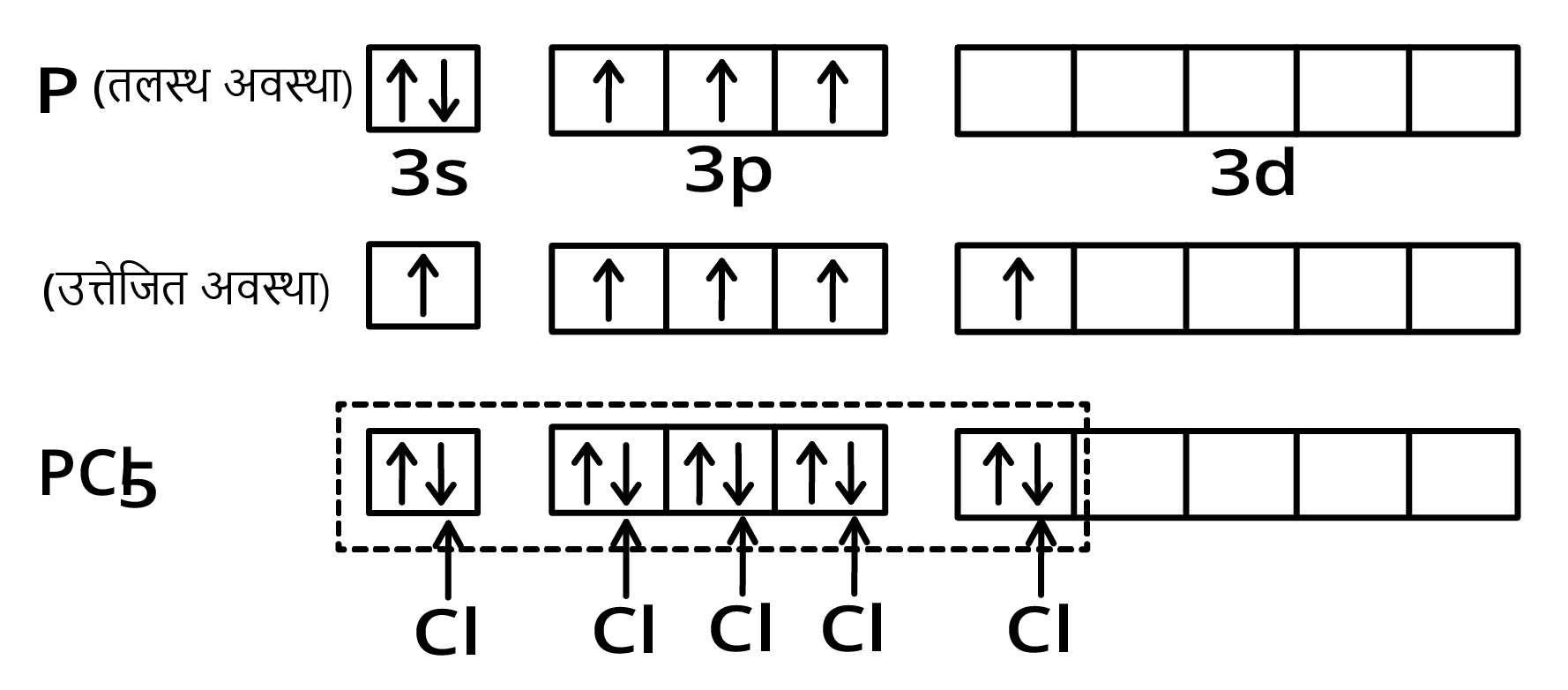
इस प्रकार पाँच कक्षक (एक \[s\], तीन \[p\] तथा एक \[d\] कक्षक) संकरण के लिए उपलब्ध होते हैं। इनके संकरण द्वारा पाँच \[s{p^3}d\] संकर कक्षक प्राप्त होते हैं, जो त्रिकोणीय द्वि-पिरामिड के पाँच कोनों की ओर उन्मुख होते हैं, जैसा चित्र में दर्शाया गया है।
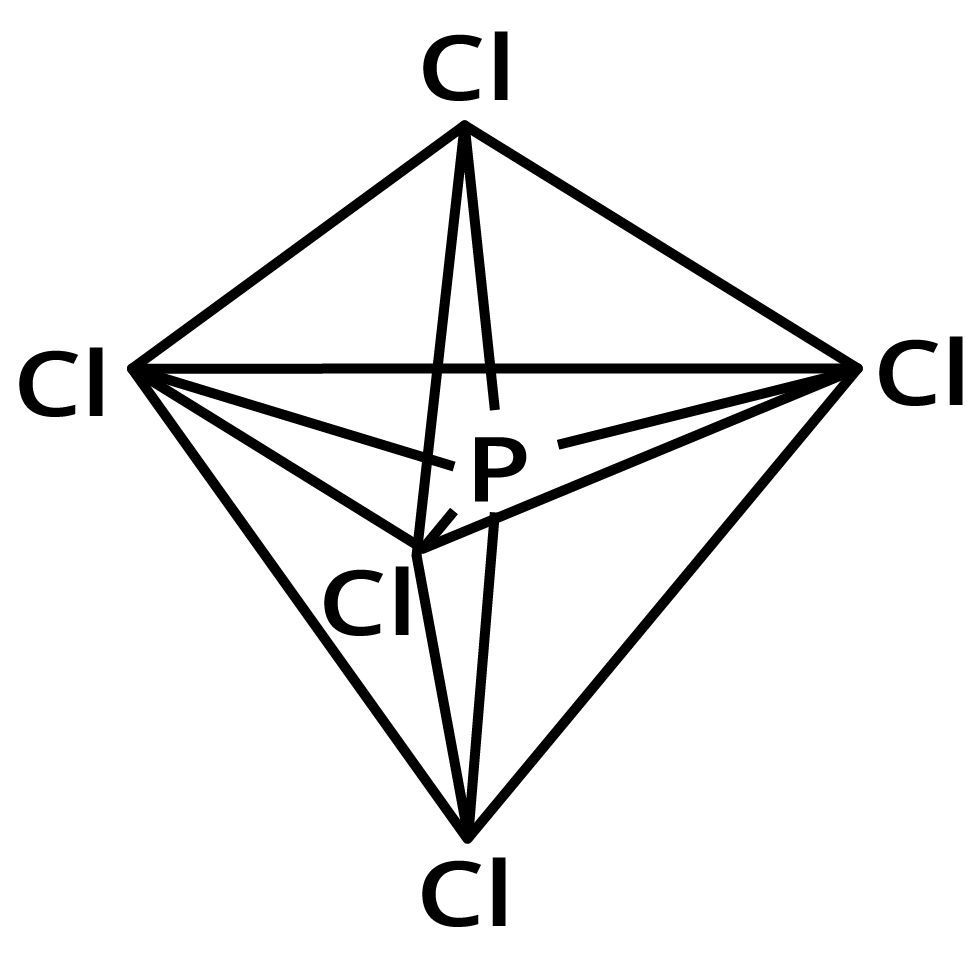
यहाँ यह तथ्य ध्यान देने योग्य है कि त्रिकोणीय द्वि-पिरामिडी ज्यामिति में सभी आबन्ध कोण बराबर नहीं होते हैं। $PC{l_5}$ में फॉस्फोरस के पाँच \[{\mathbf{s}}{{\mathbf{p}}^{\mathbf{3}}}\] संकर कक्षक क्लोरीन परमाणुओं के अर्द्ध-पूरित कक्षकों में अतिव्यापन द्वारा पाँच $PC{l_5}$ सिग्मा-आबन्ध बनाते हैं। इनमें से तीन \[P---Cl\] आबन्ध एक तल में होते हैं तथा परस्पर \[120^\circ \] का कोण बनाते हैं। इन्हें ‘विषुवतीय आबन्ध, (equatorial) कहते हैं। अन्य दो \[P---Cl\] आबन्ध क्रमशः विषुवतीय तल के ऊपर और नीचे होते हैं तथा तल से \[90^\circ \] का कोण बनाते हैं। इन्हें अक्षीय आबन्ध (axial) कहते हैं। चूंकि अक्षीय आबन्ध इलेक्ट्रॉन युग्मों में विषुवतीय आबन्धी-युग्मों से अधिक प्रतिकर्षण अन्योन्यक्रियाएँ होती हैं; अतः ये आबन्ध विषुवतीय आबन्धों से लम्बाई में कुछ अधिक तथा प्रबलता में कुछ कम होते हैं। इसके परिणामस्वरूप $PC{l_5}$ अत्यधिक क्रियाशील होता है।
39. हाइड्रोजन आबन्ध की परिभाषा दीजिए। यह वाण्डरवाल्स बलों की अपेक्षा प्रबल होते हैं या दुर्बल?
उत्तर:
हाइड्रोजन आबन्ध को उस आकर्षण बल के रूप में परिभाषित किया जा सकता है, जो एक अणु के हाइड्रोजन परमाणु को दूसरे अणु के विद्युत-ऋणात्मक परमाणु ($F,O$ या $N$) से बॉधता है। यह वाण्डरवाल्स बलों की अपेक्षा दुर्बल होते हैं।
40.“आबन्ध कोटि से आप क्या समझते हैं? निम्नलिखित में आबन्ध कोटि का परिकलन कीजिए-
\[{N_2},{\text{ }}{O_2},{\text{ }}{O^ + }_2{\text{, }}{O^--}_2\]
उत्तर:
किसी अणु यो आयन में दो परमाणुओं के बीच आबन्धों की संख्या ‘आबन्ध कोटि कहलाती है। गणितीय रूप में, यह आबन्धी तथा अनाबन्धी कक्षकों में इलेक्ट्रॉनों की संख्या में अन्तर के आधे के बराबर होती है। अर्थात्
आबन्ध कोटि $ = \dfrac{1}{2}\left( {{N_b} - {N_a}} \right)$
${{\mathbf{N}}_2}(14):\sigma {s^2}{\sigma ^*}1{s^2}\sigma 2{s^2}{\sigma ^*}2{s^2}\pi 2p_x^2\pi 2p_y^2\sigma 2p_z^2$
आबन्ध कोटि $ = \dfrac{1}{2}(10 - 4) = \dfrac{6}{2} = 3$
${{\text{O}}_2}(16):\sigma {\text{l}}{{\text{s}}^2}{\sigma ^*}1{s^2}\sigma 2{s^2}{\sigma ^*}2{s^2}\sigma 2p_z^2\pi 2p_x^2\pi 2p_y^2{\pi ^*}2p_x^1{\pi ^*}2p_y^1$
आबन्ध कोटि $ = \dfrac{1}{2}(10 - 6) = \dfrac{4}{2} = 2$
${\mathbf{O}}_2^ + (15):\sigma 1{s^2}{\sigma ^*}1{s^2}\sigma 2{s^2}{\sigma ^*}2{s^2}\sigma 2p_z^2\pi 2p_x^2\pi 2p_y^2{\pi ^*}2p_x^1$
आबन्ध कोटि $ = \dfrac{1}{2}(10 - 5) = \dfrac{5}{2} = 2 \cdot 5$
${\mathbf{O}}_2^ - (17):\sigma {\text{l}}{{\text{s}}^2}{\sigma ^*}{\text{L}}{{\text{s}}^2}\sigma 2{s^2}{\sigma ^*} \cdot 2{s^2}\sigma 2p_z^2\pi 2p_x^2\pi 2p_{{y_2}}^2{\pi ^*}2p_x^2{\pi ^*}2p_y^1$
आबन्ध कोटि $ = \dfrac{1}{2}(10 - 7) = \dfrac{3}{2} = 1 \cdot 5$
NCERT Solutions for Class 11 Chemistry Chapter 4 Chemical Bonding and Molecular Structure in Hindi
Chapter-wise NCERT Solutions are provided everywhere on the internet with an aim to help the students to gain a comprehensive understanding. Class 11 Chemistry Chapter 4 solution Hindi mediums are created by our in-house experts keeping the understanding ability of all types of candidates in mind. NCERT textbooks and solutions are built to give a strong foundation to every concept. These NCERT Solutions for Class 11 Chemistry Chapter 4 in Hindi ensure a smooth understanding of all the concepts including the advanced concepts covered in the textbook.
NCERT Solutions for Class 11 Chemistry Chapter 4 in Hindi medium PDF download are easily available on our official website (vedantu.com). Upon visiting the website, you have to register on the website with your phone number and email address. Then you will be able to download all the study materials of your preference in a click. You can also download the Class 11 Chemistry Chemical Bonding and Molecular Structure solution Hindi medium from Vedantu app as well by following the similar procedures, but you have to download the app from Google play store before doing that.
NCERT Solutions in Hindi medium have been created keeping those students in mind who are studying in a Hindi medium school. These NCERT Solutions for Class 11 Chemistry Chemical Bonding and Molecular Structure in Hindi medium pdf download have innumerable benefits as these are created in simple and easy-to-understand language. The best feature of these solutions is a free download option. Students of Class 11 can download these solutions at any time as per their convenience for self-study purpose.
These solutions are nothing but a compilation of all the answers to the questions of the textbook exercises. The answers/ solutions are given in a stepwise format and very well researched by the subject matter experts who have relevant experience in this field. Relevant diagrams, graphs, illustrations are provided along with the answers wherever required. In nutshell, NCERT Solutions for Class 11 Chemistry in Hindi come really handy in exam preparation and quick revision as well prior to the final examinations.
FAQs on NCERT Solutions For Class 11 Chemistry Chapter 4 Chemical Bonding And Molecular Structure in Hindi - 2025-26
1. How can I find the correct step-by-step NCERT Solutions for all exercises in Class 11 Chemistry Chapter 4?
You can find comprehensive, step-by-step NCERT Solutions for Class 11 Chemistry Chapter 4, Chemical Bonding and Molecular Structure, which are fully solved by subject matter experts. These solutions cover all the in-text questions and the end-of-chapter exercises, ensuring no part of the textbook is left unsolved. The methods provided are designed as per the latest 2025-26 CBSE syllabus and guidelines.
2. Why is it important to follow the method given in the NCERT Solutions for Chapter 4 when solving problems in the exam?
Following the methodology in the NCERT Solutions is crucial because it aligns directly with the CBSE marking scheme. Examiners look for specific steps, correct terminology, and a logical flow in answers. Using these expert-verified solutions ensures you learn the correct way to present your answers to maximise marks, especially for questions on hybridisation, VSEPR theory, and MOT diagrams.
3. While solving NCERT questions on VSEPR theory, what is a common mistake in determining a molecule's shape versus its geometry?
A very common mistake is confusing a molecule's geometry with its shape. NCERT solutions clarify this distinction. Geometry describes the arrangement of all electron pairs (both bonding and lone pairs), while shape describes only the arrangement of atoms. For instance, in an ammonia (NH₃) molecule, the geometry is tetrahedral (due to four electron pairs), but its shape is trigonal pyramidal because the lone pair is not included in the final shape description.
4. What is the correct method to solve NCERT questions that ask to draw Lewis structures for molecules and ions?
The correct method, as demonstrated in the NCERT solutions for Chapter 4, involves a systematic approach:
- First, calculate the total number of valence electrons for all atoms in the species.
- Next, draw the basic skeletal structure connecting atoms with single bonds.
- Distribute the remaining electrons to satisfy the octets of the terminal atoms first.
- If the central atom's octet is incomplete, create multiple bonds (double or triple) by shifting lone pairs.
- Finally, use formal charges to verify and select the most stable and accurate Lewis structure.
5. How do the NCERT Solutions for Chapter 4 help in understanding when to apply Valence Bond Theory (VBT) versus Molecular Orbital Theory (MOT)?
The NCERT Solutions clearly demonstrate the distinct applications of these theories. Problems asking to determine molecular geometry, bond angles, and hybridisation (e.g., explaining the shape of CH₄ or PCl₅) are solved using the Valence Bond Theory (VBT). In contrast, questions about the magnetic properties (paramagnetic/diamagnetic), bond order, or stability of diatomic molecules like O₂, N₂, or their ions are solved using the Molecular Orbital Theory (MOT).
6. Where can I find solved NCERT numericals for calculating bond order and predicting magnetic properties using MOT?
The NCERT solutions for Chapter 4 provide detailed, solved examples for these specific problems. For a species like O₂⁺, the solutions guide you to:
- Write the correct Molecular Orbital configuration based on the total number of electrons.
- Calculate the bond order using the formula: ½ (Bonding electrons - Antibonding electrons).
- Check for the presence of unpaired electrons in the molecular orbitals to determine if the species is paramagnetic or diamagnetic.
7. When solving NCERT questions on hybridisation, how do the solutions explain the involvement of d-orbitals in molecules like SF₆?
The NCERT solutions for questions on molecules like SF₆ (which has an octahedral geometry) explain that the central sulfur atom accommodates more than eight electrons, a phenomenon known as an expanded octet. To form six bonds with fluorine, the solutions illustrate that the central atom utilises its empty, low-lying 3d-orbitals in addition to its 3s and 3p orbitals. This leads to sp³d² hybridisation, which is clearly explained in the step-by-step solution.
8. Do the Class 11 Chemistry Chapter 4 NCERT Solutions cover conceptual questions on hydrogen bonding and its effects?
Yes, absolutely. The NCERT Solutions for Chapter 4 thoroughly address all conceptual questions related to hydrogen bonding. They provide clear, step-by-step explanations for textbook problems that require comparing the boiling points of compounds (e.g., H₂O vs. H₂S) or explaining the high viscosity and surface tension of water, attributing these properties to the presence of extensive intermolecular hydrogen bonds.

















